Tác giả: Tiến sĩ – Bác sĩ Hoàng Gia Du – Trưởng khoa Chấn thương chỉnh hình và Cột sống Bệnh viện Bạch Mai.
Đại cương
Cột sống cổ cao là vùng bản lề cổ – chẩm, bao gồm lồi cầu xương chẩm (C0) và hai đốt sống cổ trên cùng: đốt đội (C1) và đốt trục (C2), các thành phần giải phẫu này liên kết với nhau bằng hệ thống khớp và dây chằng phức tạp của cơ thể, rất linh hoạt về chức năng, nhưng yếu về cấu trúc giải phẫu, do vậy các hình thái tổn thương giải phẫu cũng đa dạng, phức tạp và riêng biệt [39].
Do sự phức tạp trong cấu trúc giải phẫu cũng như mối liên quan của về chức năng của phức hợp đội – trục nên việc phân chia các tổn thương giải phẫu rất đa dạng, chi tiết và có nhiều ứng dụng thiết thực trong thực tế lâm sàng và trong phẫu thuật.
Bên cạnh đó, phức hợp đội – trục có rất nhiều biến thể giải phẫu, việc hiểu biết về cấu trúc – chức năng giải phẫu và các biến thể giải phẫu này giúp các phẫu thuật viên đánh giá được tốt hơn các tổn thương và dự phòng các biến chứng trong phẫu thuật.
I. Giải phẫu cột sống cổ cao
1.1. Cấu trúc xương
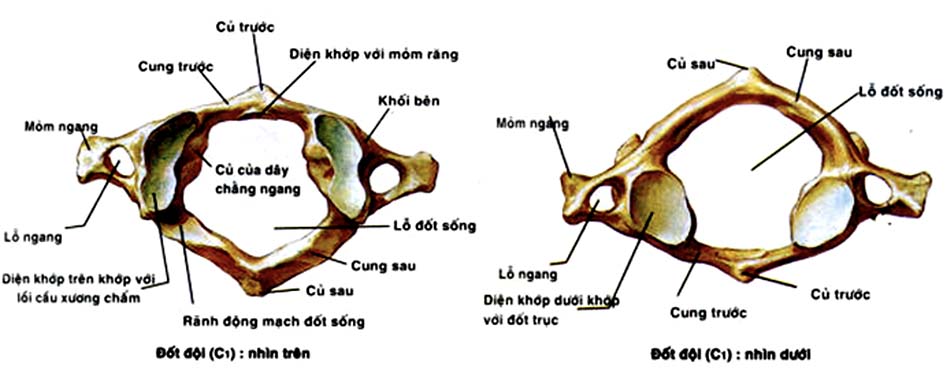
Đốt đội: có hình chiếc nhẫn, gồ ghề, không bằng phẳng, hai khối bên rộng, đây là đốt sống duy nhất trong cột sống mà thân đốt không liên quan đến đĩa đệm. Đốt đội có chiều ngang lớn nhất trong tất cả các đốt sống, trung bình chiều ngang 78,6 mm, cao 15,4 mm, chiều trước sau 45,8 mm. Đường kính trung bình trước sau ống tủy C1 khoảng 31,7 mm chiều ngang khoảng 32,2 mm, trong ống tủy chứa tủy sống, mỏm nha và dây chằng ngang [21],[49].
Độ dày xương cứng của cung trước phía ngoài khoảng 1,9 mm, phía trong khoảng 1,6 mm, cung sau tương tự khoảng 1,5 mm. Độ cao trung bình của cung trước C1 khoảng 6 ± 1 mm, cung sau vào khoảng 8 ± 2mm [21]. Trong kỹ thuật bắt vít vào khối bên C1 trong các phẫu thuật lối sau, chúng ta cần đánh giá cấu trúc cung sau C1 và biến thể của động mạch đốt sống. Nếu cung sau C1 không đủ cao, nguy cơ vỡ cung sau khi bắt vít khối bên C1 qua cung sau rất cao. Vì vậy chúng ta nên chuyển sang kỹ thuật vít khối bên C1 kiểu cổ điển (Phẫu thuật Harms cổ điển).
Phần dày nhất của cung trước C1 ở chính giữa gọi là củ trước để dây chằng bám kích thước khoảng 6,4m. Mặt sau củ trước có diện tiếp khớp với mỏm nha của đốt trục, cung trước mỏng dần về hai bên, nơi tiếp giáp với khối bên là nơi mỏng nhất do vậy đây là điểm yếu, dễ gãy khi bị chấn thương. Phần dầy nhất của cung sau ở chính giữa gọi là củ sau kích thước khoảng 0,8 mm, cung sau cũng mỏng dần về hai bên, chỗ tiếp giáp với khối bên mỏng nhất do vậy vị trí này cũng yếu dễ gãy khi bị chấn thương. Các điểm yếu của C1 là ở điểm giao của các điểm cốt hóa xương từ thời kỳ bào thai, các cơ chế chấn thương gây vỡ C1 thường là cơ chế gập ép, vì vậy khi chấn thương các mảnh vỡ của đốt đội thường có xu hướng ly tâm nên không gây chèn ép ống sống, hơn nữa đường kính ống sống vùng này rộng hơn nhiều so với các đoạn khác của tủy sống, điều này lý giải tại sao trong chấn thương cột sống cổ cao nói chung và đốt đội nói riêng ít gặp tổn thương thần kinh hơn so với các chấn thương tủy sống khác [21].
Khối bên là nơi gặp nhau của cung trước và cung sau, phía ngoài là mỏm ngang, ở giữa mỏm ngang có lỗ ngang nơi động mạch ống sống chui qua để vào hộp sọ. Phía trước trên cung sau, ngay sau khối bên có rãnh ĐM đốt sống. 5% dân số có cấu trúc cung sau không hoàn chỉnh vì vậy trước khi phẫu thuật cần có thăm dò đánh giá sự hoàn chỉnh của cung sau đốt đội. Trong cùng mặt trên là diện khớp lõm lòng chảo tạo nên ổ khớp với lồi cầu xương chẩm gọi là khớp cổ chẩm, mặt dưới là diện khớp với đốt trục. Mặt trên khối bên đốt đội còn có các rãnh với đường kính trung bình 5mm để động mạch đốt sống và rễ thần kinh chạy lên. Mặt dưới khối bên đốt đội là diện khớp với đốt trục. Kích thước trung bình của khối bên theo chiều trước sau khoảng 17,21 mm, ngang khoảng 15,47 mm, độ dày khoảng 14,09 mm [18] [21] .
Mỏm nha: hình cột trụ, hướng thẳng lên trên, cao khoảng 15 mm, được cố định bởi ổ khớp của mỏm nha với phía trước là cung trước đốt đội và phía sau là dây chằng ngang. Thân của mỏm nha được phát triển từ lớp trung mô phôi của đoạn tủy thần kinh cổ 1 và nằm ở trung tâm của đốt sống C1 [43]. Trên cùng mỏm nha gọi là đỉnh nha, mặt trước của đỉnh nha có diện khớp tiếp khớp với hõm khớp của mặt sau cung trước đốt đội và mặt sau đỉnh nha có diện khớp tiếp khớp với dây chằng ngang. Mỏm nha cấu tạo gồm ba phần, ngoài đỉnh nha, còn có thân mỏm nha, và nền mỏm nha, là nơi liên tiếp với thân đốt trục. Mỏm nha không nằm thẳng đứng mà nằm chếch ra phía sau, tạo với mặt phẳng đứng dọc góc chếch trung bình 13 độ. Mỏm nha được coi như là phần thân đốt đội dính vào đốt trục, có tác dụng như một trục để xương sọ và đốt đội quay quanh.
Trong quá trình phát triển tách ra khỏi đốt đội và gắn với phần còn lại của đốt trục. Mũi của mỏm nha được phát triển từ trung mô phôi của phần cuối tủy thần kinh vùng chẩm hoặc tiền đốt đội. Quá trình vôi hóa của 2 thành phần này của mỏm nha diễn ra riêng biệt.
Từ tháng 1 đến tháng 5 trong bào thai, mỏm nha bắt đầu vôi hóa từ 2 điểm nằm đối xứng qua đường giữa. Đến thời điểm sinh, mỏm nha đã liền thành 1 khối.
Đôi khi, hai phần trái và phải của mỏm nha không liền lúc sinh, khi đó đường giữa không liền. Vào thời điểm trẻ sinh ra, đỉnh mỏm nha chưa vôi hóa và có dạng chữ V hay còn gọi mỏm nha hình hai sừng.
Quá trình vôi hóa của vùng trung tâm diễn ra riêng biệt và có thể thấy khi trẻ 3 tuổi và liền với toàn bộ mỏm nha khi trẻ đạt 12 tuổi. Cattell và Filtzer thấy vùng cốt hóa trung tâm trên 26% trên 70 trường hợp trẻ em 5-11 tuổi [12],[43].
Khi trẻ mới sinh, mỏm nha và thân đốt trục bị chia cắt bởi dải sụn sợi được thể hiện như tấm sụn phát triển [44]. Tấm sụn phát triển này không cắt ngang đáy của mỏm nha ở mặt trên của diện khớp bên của đốt trục mà nằm trong thân của đốt sống này. Vì vậy, phần mỏm nha nằm dưới diện khớp bên được coi là thân của mỏm nha. Trong tư thế chụp há miệng, mỏm nha nằm giống như nút chai, kẹp giữa hai cung bên C1. Đường sụn tiếp hợp này luôn thấy ở trẻ 3 tuổi và khoảng 50% ở trẻ 4 tuổi, nhưng sẽ biến mất khi trẻ lên 6 tuổi. Ở trẻ nhỏ, phần mỏm nha chưa vôi hóa có thể bị nhầm với thiểu sản mỏm nha.
Nguồn cấp máu cho mỏm nha gồm 2 nguồn. Động mạch đốt sống cấp máu cho hai nhánh lên trước và sau ở mức C3 và đi vòng qua mặt trước và mặt lưng của thân đốt trục và mỏm nha, tạo thành hệ mạch nối trong vùng dây chằng cánh. Các động mạch này cấp các nhánh xiên cho thân đốt trục và mỏm nha. Các nhánh động mạch sau lên chạy dọc trước 2 bên của mỏm nha và cung động mạch nhận máu cấp từ đông mạch cảnh nằm trên đáy sọ và song song với dây chằng cánh. Do đặc điểm cấp máu cho mỏm nha và thân C2 như vậy nên trong chấn thương gãy mỏm nha loại 1 và loại 2 rất khó liền xương ổ gãy, dễ gây ra khớp giả mỏm nha và có nguy cơ trật C1-C2. Trong thực hành lâm sàng hiện nay, khi có gãy mỏm nha loại 2, nhiều tác giả xem như là một tổn thương mất vững và có chỉ định cố định cột sống ghép xương C1-C2. Song vẫn có một số tác giả ưu tiên lựa chọn giải pháp theo dõi và đeo nẹp cổ cứng 6 tuần, sau đó chụp lại cắt lớp vi tính qua ổ gãy xương và Xquang cột sống cổ tư thế cúi – ưỡn nhằm đánh giá sự ổn định của phức hợp C1-C2, nếu có xuất hiện tình trạng liền xương ổ gãy và chỉ số ADI (Khoảng cách từ bờ sau củ trước C1 đến mỏm nha) trên Xquang trong giới hạn bình thường thì có thể chỉ cần điều trị bảo tồn. Tuy nhiên do sự tuân thủ điều trị cũng như tính chất giải phẫu xương và mạch máu vùng này nên tỷ lệ bệnh nhân điều trị bảo tồn thất bại từ 40 – 60%.
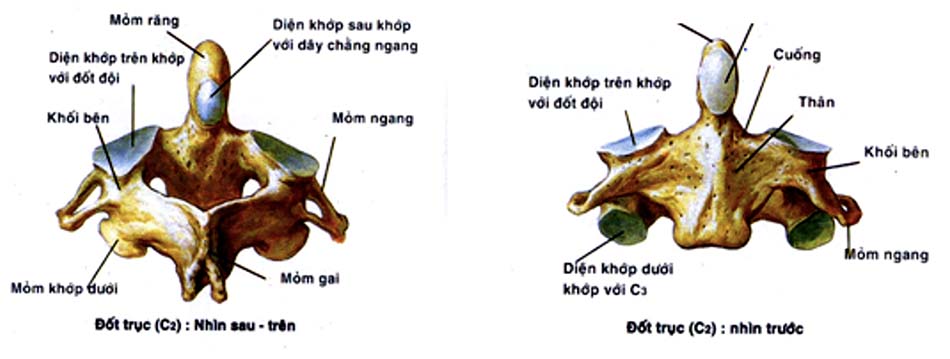
Thân và cuống: phía trên liên tục với mỏm nha, mặt trên thân đốt trục ở hai bên của mỏm nha có diện tiếp khớp với đốt đội, mặt dưới là diện tiếp khớp với C3.
Diện tiếp khớp với khối bên C1 khoảng 211.3 mm2, chiều cao thân C2 khoảng 23.3 mm cộng với chiều cao của mỏm nha kích thước khoảng 39.9 mm [43]. Đường kính trung bình thân C2 khoảng 16.2mm, mỏm nha là 11.2 mm tại phần to nhất của mỏm nha, phần đỉnh. Đường kính cuống C2 trung bình là 7,8mm, chiều dài cuống trung bình 8mm, cuống C2 hợp với mặt phẳng đứng dọc góc trung bình 23,3 độ.
Góc của mỏm nha hơi đổ về phía sau so với đường giữa khoảng 13o [43]. Đây là cơ sở để tiến hành thực hiện kỹ thuật vít trực tiếp mỏm nha bằng lối vào cổ trước trong điều trị gãy mỏm nha type 2. Với những trường hợp cột sống cổ tư thế gù, dù mỏm nha có đổ ra sau 1 cách sinh lý thì cũng khó có thể tiến hành kỹ thuật vít trực tiếp mỏm nha vì không đủ góc ưỡn ở tư thế nằm ngửa để tiến hành phẫu thuật mà chỉ thuận lợi cho các kỹ thuật phẫu thuật lối sau như vít qua khớp C1C2 hoặc phẫu thuật Harms.
1.2. Các khớp của cột sống cổ cao
1.2.1. Khớp chẩm – đội
Là khớp hoạt dịch, cấu thành bởi lồi cầu xương chẩm và diện khớp trên của đốt đội, các diện khớp lõm của đốt đội vừa khít với các lồi cầu [6]. Khớp này cho phép vận động cúi ngửa khoảng 13 độ, nghiêng hai bên khoảng 8 độ. Không có cử động quay ở khớp này [16].
Các phương tiện nối khớp là bao khớp và các màng chẩm – đội. Màng chẩm – đội trước căng từ bờ trước lỗ lớn xương chẩm tới bờ trên cung trước đốt đội, hai bên màng này hoà lẫn với bao khớp thành dây chằng chẩm – đội bên, còn ở giữa màng này được tăng cường bởi dây chằng dọc trước căng từ mỏm nền xương chẩm đến củ trước của đốt đội [34]. Lồi cầu xương chẩm tiếp xúc với diện khớp trên của C1, kích thước của mỗi lồi cầu trung bình dài 23,4 mm, rộng 10,6 mm, cao 9,2mm, khoảng cách giữa hai bờ trong lồi cầu xương chẩm phía trước khoảng 21,0 mm, sau 41,6 mm [16]. Tủy cổ chui vào lỗ chẩm kích thước khoảng 12.2 mm tính từ bờ sau của lỗ chẩm.
1.2.2. Khớp đội trục
Có 3 khớp hoạt dịch giữa đốt đội và đốt trục gồm: khớp đội trục giữa và hai khớp đội trục bên đảm bảo 50 % chức năng vận động quay của cột sống cổ. Chuyển động chính của khớp đội trục là xoay với vận động xoay trung bình mỗi bên là 23,3 độ đến 38,9 độ [9].
Khớp đội trục giữa:
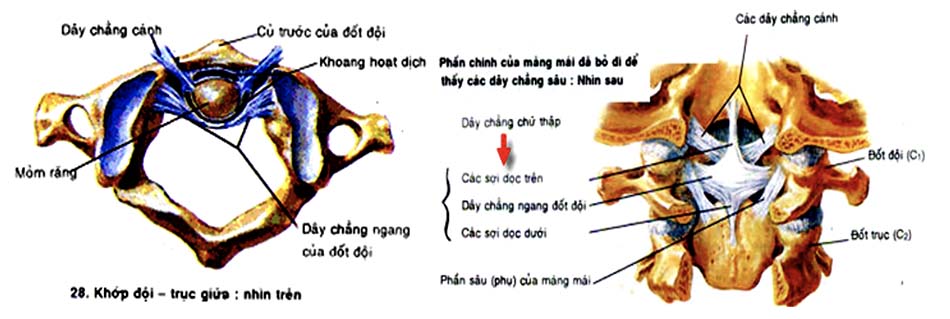
Là khớp giữa mỏm nha đốt trục với một vòng tròn do cung trước đốt đội và dây chằng ngang đốt đội [6] (là dải ngang của dây chằng chữ thập tạo nên).
Dây chằng hình chữ thập: gồm một dải chạy ngang, nối mặt trong của hai khối bên đốt đội gọi là dây chằng ngang và các bó dọc, nối bờ trên của dải ngang với xương chẩm và bờ dưới của dải ngang với đốt trục. Dây chằng hình chữ thập giữ cho mỏm nha áp vào mặt sau cung trước đốt đội và chia lỗ đốt sống của đốt đội làm hai phần. Phần sau chứa tuỷ sống, phần trước chứa mỏm nha. Mặt sau dây chằng chữ thập có màng mái từ mặt sau thân đốt trục chạy lên hoà lẫn với màng cứng của sọ não và là thành phần tiếp tục của dây chằng dọc sau [49]. Ở trước dây chằng ngang, mỏm nha được cố định bởi hai dây chằng:
- Dây chằng đỉnh nha: từ đỉnh mỏm nha đến bờ trước lỗ lớn xương chẩm.
- Dây chằng cánh: ở hai bên và đi từ bờ bên của đỉnh nha đến mặt trong lồi cầu xương chẩm. Dây chằng này hạn chế cử động xoay ở khớp đội trục giữa.
Dây chằng ngang: đốt đội khoẻ hơn mỏm nha, do vậy khi gặp chấn thương, mỏm nha thường bị gãy trước khi rách dây chằng này. Tuy vậy dây chằng ngang ở một số người không khoẻ như bình thường và là một trong những nguyên nhân bệnh lý gây ra mất vững của khớp đội trục. Khi đứt dây chằng ngang hoặc giãn dây chằng ngang trong các bệnh lý bẩm sinh, mỏm nha sẽ không được giữ lại ở vị trí bình thường trong khớp đội trục giữa mà có xu hướng đi ra phía sau gây hẹp ống sống và chèn ép thần kinh. Lúc này chỉ số ADI được sử dụng để đánh giá sự mất vững của phức hợp đội trục để ra quyết định điều trị.
Các dây chằng cánh yếu hơn, các cử động gấp và xoay đầu kết hợp có thể làm đứt một hoặc cả hai dây chằng cánh. Đứt một bên sẽ làm tăng tầm xoay 30% về phía đối diện.
Đường kính trước sau của đốt đội khoảng 3cm, mỏm nha khoảng 1 cm, tuỷ chiếm 1cm, còn lại là các tổ chức phần mềm bao quanh tuỷ sống. Chính vì vậy đây là vùng rất linh hoạt trong vận động, ít gặp tổn thương thần kinh khi chấn thương và nếu có chèn ép do các nguyên nhân trong ống sống thường có diễn biến từ từ.
Khớp đội – trục bên
Là khớp hoạt dịch phẳng giữa diện khớp trên đốt trục với diện khớp dưới đốt đội. Các cử động của khớp đội – trục xảy ra đồng thời cả ba mặt khớp. Chuyển động chính của cấu trúc C1 – C2 là chuyển động xoay; Tầm xoay quanh trục bình thường của khớp đội – trục là 47o, 77% chuyển động xoay của cột sống cổ là do cấu trúc C1 – C2 thực hiện, 4% là do cấu trúc chẩm đội, còn lại là xoay quanh trục của các đốt sống khác. Chuyển động xoay được giới hạn bởi dây chằng ngang, dây chằng cánh, diện khớp C1 – C2 và cấu trúc bao khớp. Chuyển động xoay mỗi bên của cấu trúc C1 – C2 dao động từ 23,3 độ đến 38,9 độ.
Chuyển động nghiêng của cấu trúc C1 – C2 mỗi bên trung bình 11 độ, chuyển động nghiêng được giới hạn bởi màng mái, dây chằng cánh, diện khớp C1 – C2 [6]. Hoạt động cúi – ưỡn của cấu trúc C1 – C2 trung bình 6,8 độ và được giới hạn bởi dây chằng cánh và dây chằng ngang [6, 21].
Khi tiến hành kỹ thuật vít qua khớp C1 – C2, hướng đi của vít sẽ qua khớp đội trục bên và với một kỹ thuật vít tiêu chuẩn sẽ đi qua 4 thành xương cứng ở mỗi khớp; hơn nữa phẫu thuật trực tiếp cố định khớp có biên độ xoay lớn này tạo sự vững chắc cho phức hợp C1 – C2.
1.3. Thần kinh
Cấu trúc thần kinh ở cột sống cổ gồm: Tuỷ và rễ thần kinh. Tuỷ cổ bắt đầu từ lỗ chẩm tiếp theo hành tuỷ. Tuỷ cổ rộng ra ở C3 và rộng nhất ở C6 với chu vi 38mm. Đó là kết quả của sự cung cấp thần kinh tăng dần cho chi trên. Tuỷ gồm chất trắng và chất xám có thể phân biệt được trên phim chụp cộng hưởng từ.
+ Chất trắng chứa các sợi thần kinh và chất đệm, được chia thành 3 cột: Cột sau, cột bên và cột trước. Cột sau chi phối cảm giác sâu. Cột bên chứa các bó vận động và các bó cảm giác bắt chéo chi phối cảm giác đau và nhiệt. Cột trước chứa đường của bó gai đồi trước chi phối cảm giác sờ.
+ Chất xám chứa thân tế bào của nơron thần kinh. Nơron cảm giác ở sừng sau, nơron vận động ở sừng trước của chất xám. Chi phối nội tạng của chất xám nằm ở sừng bên. Giống như não, tuỷ được bao phủ bởi màng mềm trong chứa dịch não tuỷ, ngoài cùng là màng cứng. Tuỷ cổ bám vào màng cứng bằng các dây chằng răng lược ở hai bên, giữa hai rễ thần kinh. Ở mỗi tầng tuỷ, tuỷ cho ra các rễ vận động và cảm giác. Rễ vận động ở sừng trước, rễ cảm giác ở sừng sau. Mỗi rễ gồm từ 6- 8 nhánh rễ. Rễ vận động và cảm giác chui qua màng cứng, hợp nhất thành rễ thần kinh ở mỗi tầng, chui vào lỗ tiếp hợp ở giữa các đốt sống và chui ra ngoài.
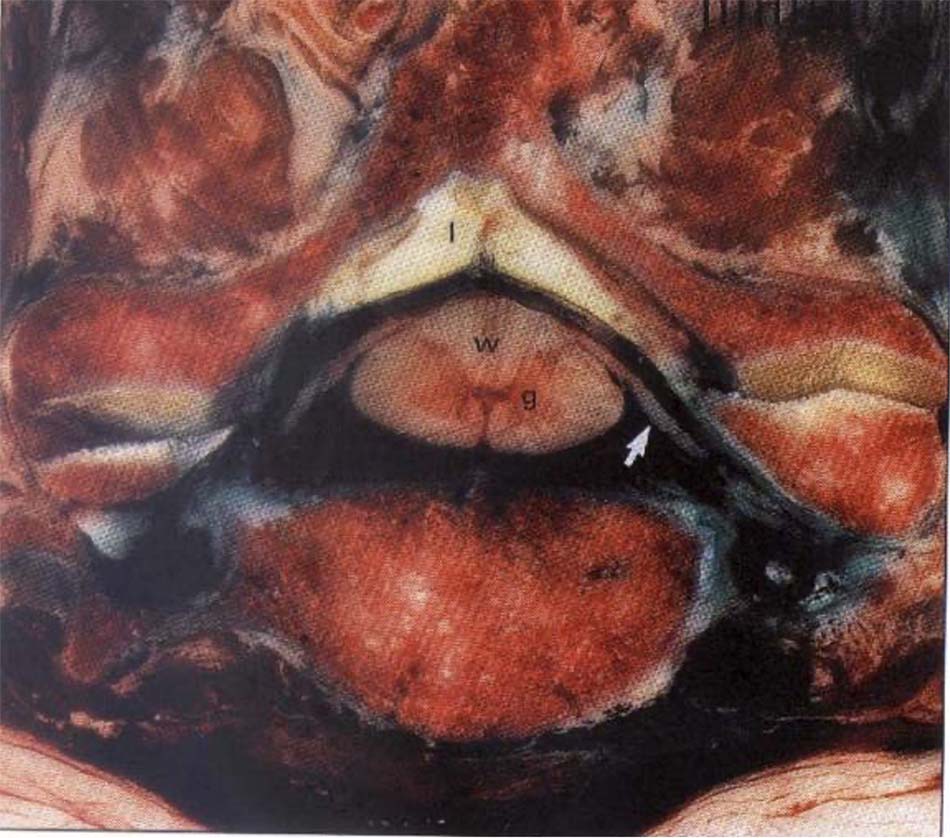
Liên quan với thần kinh hạ thiệt (Thần kinh XII)
Các nghiên cứu giải phẫu trên xác mô tả vị trí giải phẫu bình thường của thần kinh hạ thiệt (XII). Với đường kính trung bình 2 – 3 mm, thần kinh hạ thiệt sau khi thoát ra từ hộp sọ chạy thẳng xuống dưới qua mặt trước của khối bên C1, thường nằm giữa khối bên C1 và diện khớp C1 – C2 .
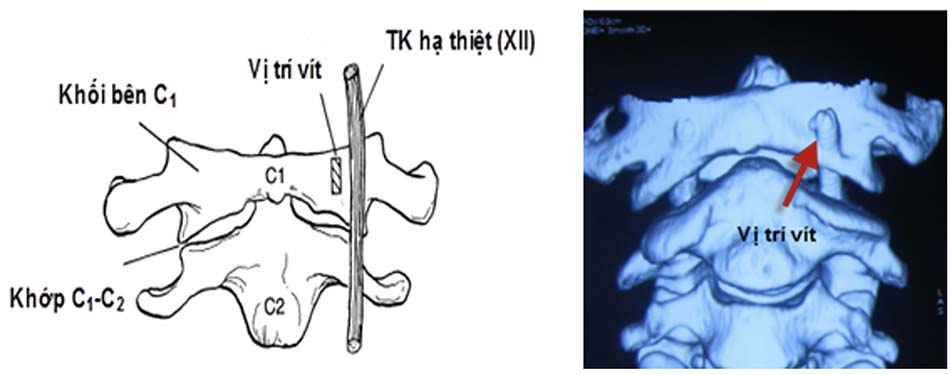
Khi vít quá dài hoặc vị trí vít không chính xác với hướng vít sang bên ngoài khối bên C1 dễ gây tổn thương thần kinh hạ thiệt. Với kỹ thuật vít qua khớp C1 – C2 chính xác theo Magerl không gây tổn thương thần kinh này [19].
Chiều dài vít trung bình được sử dụng trong phẫu thuật là 41,23 ± 2,016 mm, trong đó có 3 vít đa trục dài 40 mm được sử dụng vít qua khớp C1 – C2 trong tổn thương gãy mỏm nha phối hợp vỡ C2, chiều dài vít dài nhất là 44 mm.
Nabil A. Ebraheim và cộng sự nghiên cứu trên 20 bệnh nhân được sử dụng kỹ thuật vít qua khớp C1 – C2 theo kỹ thuật của Magerl cho kết quả chiều dài vít trung bình là 38,1 ± 2,2 mm, chiều dài vít ngắn nhất là 34 mm và vít dài nhất là 43 mm. Ở một nghiên cứu khác, theo Gebhard J.S. và Jeanneret chiều dài vít trung bình vít qua khớp C1 – C2 là 44,6 mm (42-48 mm) [19].
Raj Bahadur và cộng sự trong nghiên cứu 38 trường hợp vít qua khớp C1 – C2 điều trị các tổn thương mất vững C1 – C2 theo kỹ thuật của Magerl nhận thấy chiều dài vít trung bình tác giả đã sử dụng là 42mm [14].
Do đó, khi phẫu thuật cần lưu ý tất cả vít đều được đo trước khi bắt vít dựa vào đánh giá trên phim chụp cắt lớp trước mổ, chiều dài mũi khoan đo trực tiếp trong mổ dựa trên máy C.arms hoặc thăm dò bằng dụng cụ đo chiều dài của vít.
1.4. Mạch máu
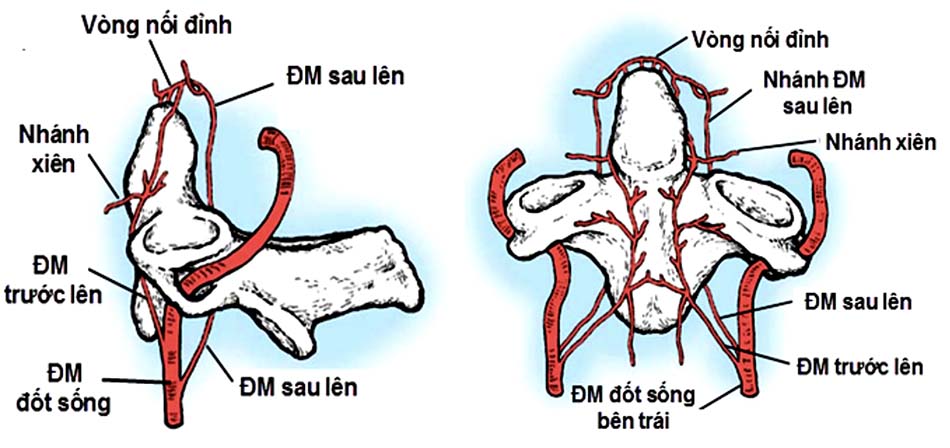
Động mạch đốt sống là động mạch chính cung cấp máu cho cột sống và tủy cổ. Động mạch này bắt nguồn từ động mạch dưới đòn. Trong hầu hết các trường hợp động mạch chui vào lỗ ngang của C6 (đôi khi có sự thay đổi về giải phẫu). Động mạch đốt sống chạy trong các lỗ ngang của các đốt sống, dọc theo hai bên của cột sống cổ, sau đó vòng qua ụ bên và cung sau C1 rồi chui vào lỗ chẩm [5].
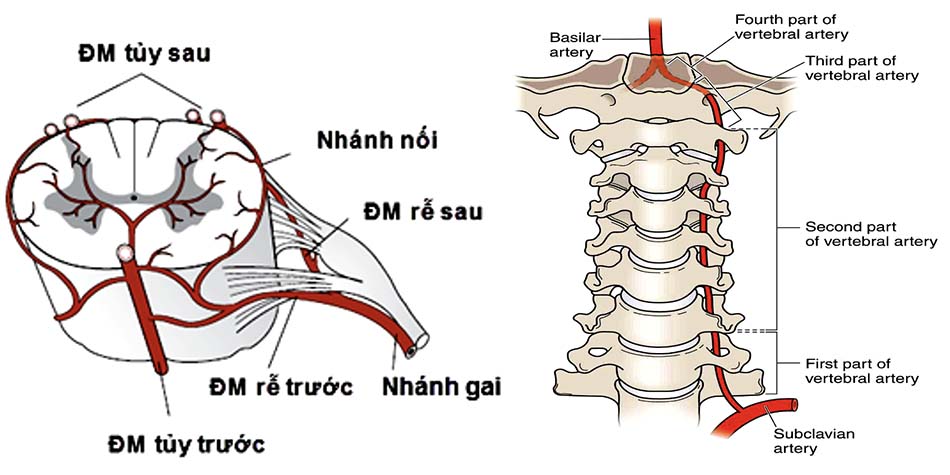
Động mạch tủy trước và tủy sau nuôi dưỡng cho tủy, trong đó nguồn chính là động mạch tủy trước. Ngoài ra tủy còn được cấp máu bởi động mạch rễ và các nhánh ngang của động mạch đốt sống ở mỗi đốt sống. Từ tủy, máu trở về hệ thống tĩnh mạch qua 3 tĩnh mạch trước và 3 tĩnh mạch sau. Các tĩnh mạch này liên kết với nhau qua các đám rối ở mặt trước và mặt sau tủy.
Khi phẫu thuật bộc lộ vào vùng này, phẫu thuật viên nên lưu ý không nên phẫu tích quá 2cm so với đường giữa vì nguy cơ làm tổn thương động mạch đốt sống. Ngoài ra khi bộc lộ vào vùng diện khớp đội trục bên C1 – C2 chúng ta cũng lưu ý đám rối tĩnh mạch ngoài màng cứng, đám rối tĩnh mạch này rất dễ rách và khó cầm máu. Với phương pháp mổ vít qua khớp, chúng ta ít phải bộc lộ đám rối tĩnh mạch vùng này, tuy nhiên trong phẫu thuật Harms, việc xác định bờ trong khối bên C1 nhằm tăng độ an toàn trong mổ đòi hỏi phẫu thuật viên phải phẫu tích lớp màng xương và đám rối tĩnh mạch vùng này nhiều hơn nên dễ gây chảy máu ảnh hưởng đến quá trình phẫu thuật.
Hơn nữa khi khoan và bắt vít trong những trường hợp cung sau C1 nhỏ cũng hay gây vỡ và tổn thương đám rối tĩnh mạch vùng này.
1.4.1. Mối liên quan giữa động mạch đốt sống và cấu trúc C1-C2
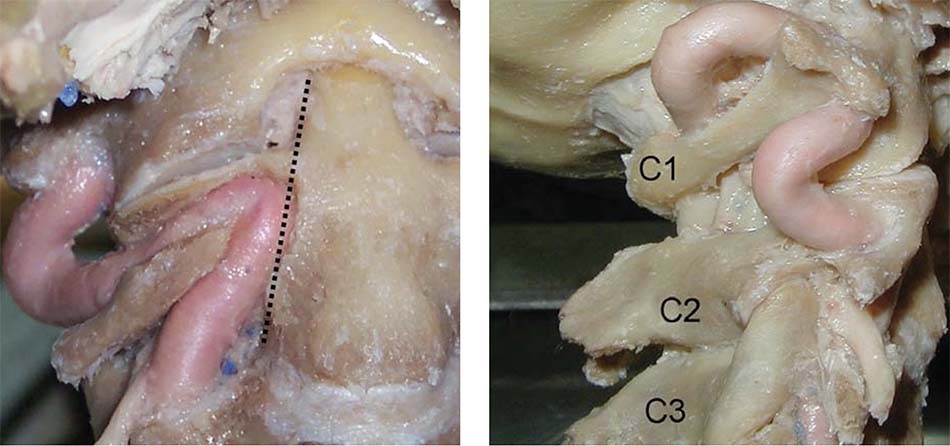
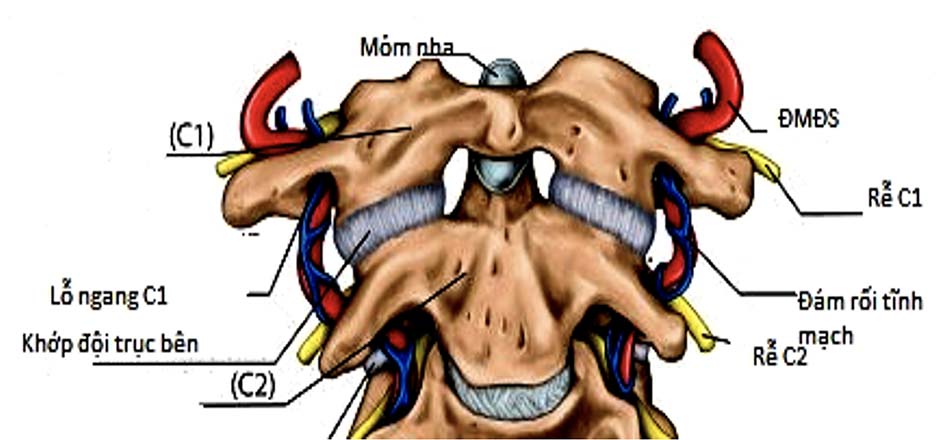
- Đoạn V1: Từ lỗ ngang đốt sống C3 đến lỗ ngang đốt sống C2 Sau khi ra khỏi lỗ ngang đốt sống C3, động mạch đi lên trên và ra trước tạo thành rãnh động mạch trong thân đốt sống C2. Khi lên gần tới diện khớp C1 – C2 động mạch đi vòng ra sau (tạo góc trung bình 86 độ) song song với diện khớp C1 – C2 để vào lỗ ngang đốt sống C2. Khoảng các đường giữa thân đốt sống C2 đến động mạch đốt sống trung bình 11,7mm [54].
- Đoạn V2: Từ lỗ ngang đốt sống C2 đến lỗ ngang đốt sống C1 Động mạch đi từ lỗ ngang đốt sống C2 đến lỗ ngang đốt sống C1, đoạn này chủ yếu động mạch liên quan đến hai rễ xuất phát từ hạch thần kinh của C2. Động mạch nằm phía trước của hai rễ thần kinh C2. Khoảng cách từ rễ thần kinh C2 đến động mạch trung bình 8mm [54].
- Đoạn V3: Từ lỗ ngang đốt sống C1 đến lỗ chẩm Sau khi thoát ra khỏi lỗ mỏm ngang đốt sống C1, động mạch đi lên trên và vòng ra sau 1 góc 90 độ tạo một rãnh động mạch ở bờ trên cung sau đốt sống C1 sau đó chui qua lỗ chẩm cùng tuỷ sống đi vào trong não. Rễ thần kinh của C1 nằm sau và dưới so với động mạch đốt sống, chiều dài động mạch đoạn này trung bình 35mm. Khoảng cách từ đường giữa đến rãnh động mạch đốt sống trung bình 22,1mm [54].
![Phân đoạn ĐMĐS vùng C1 - C2 [54]](https://osdbachmai.com/wp-content/uploads/2021/01/phan_doan_dmds.jpg)
1.4.2. Biến thể giải phẫu ĐMĐS và các chỉ số giải phẫu quan trọng
ĐMĐS đoạn C1 là cấu trúc giải phẫu rất được quan tâm, đặc biệt trong phẫu thuật vít khối bên C1 (trực tiếp hoặc qua cung sau). Đường kính trung bình của động mạch đốt sống đoạn này từ 2,3mm – 7,4mm (trung bình 4,6mm). ĐMĐS hai bên thường không có sự tương đồng về kích thước. Bên phải thường nhỏ hơn bên trái. Gọi là thiểu sản khi ĐK ĐM bé hơn 50% so với ĐK ĐM bên đối diện. Định nghĩa tương tự cũng áp dụng với thiểu sản lỗ ngang [54, 55].
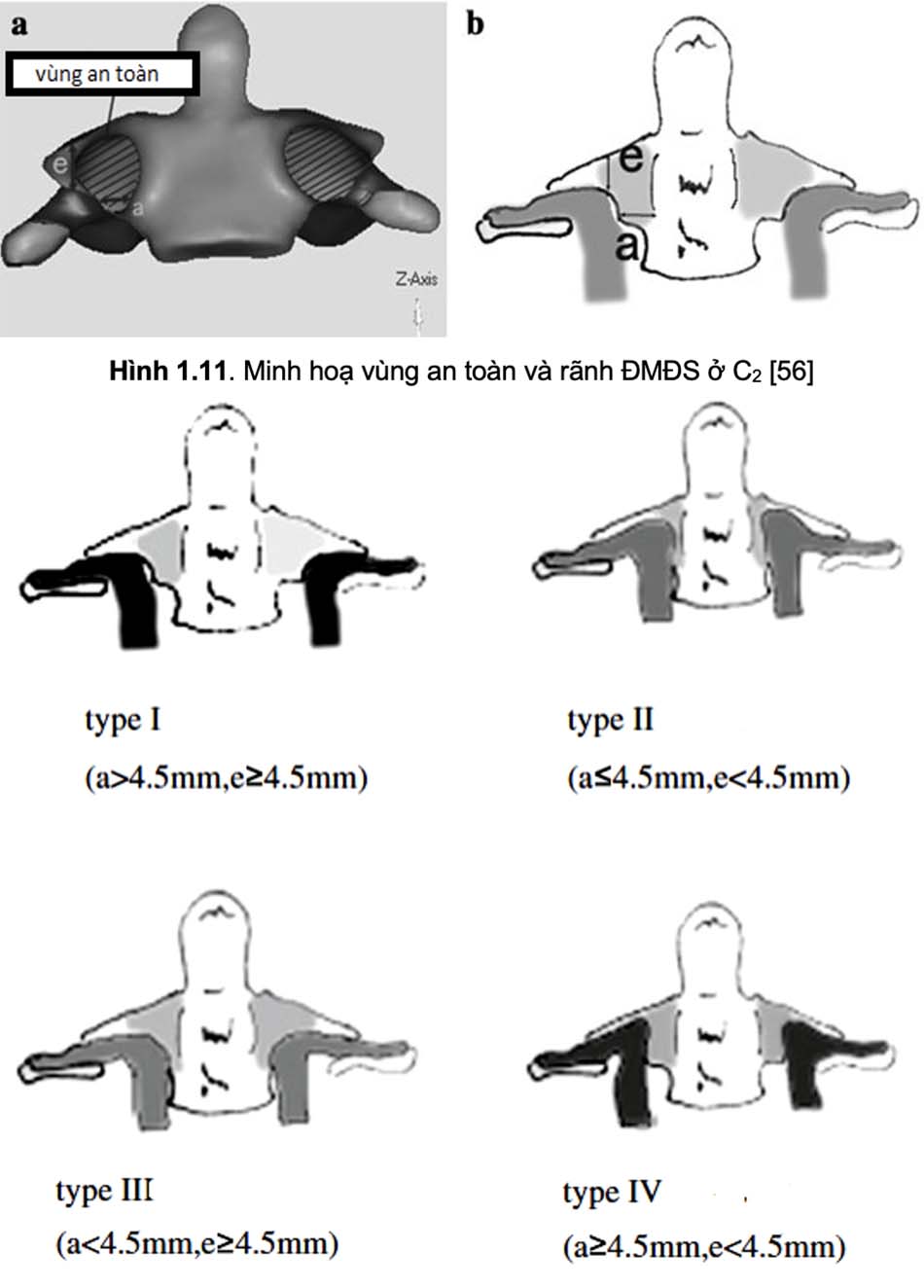
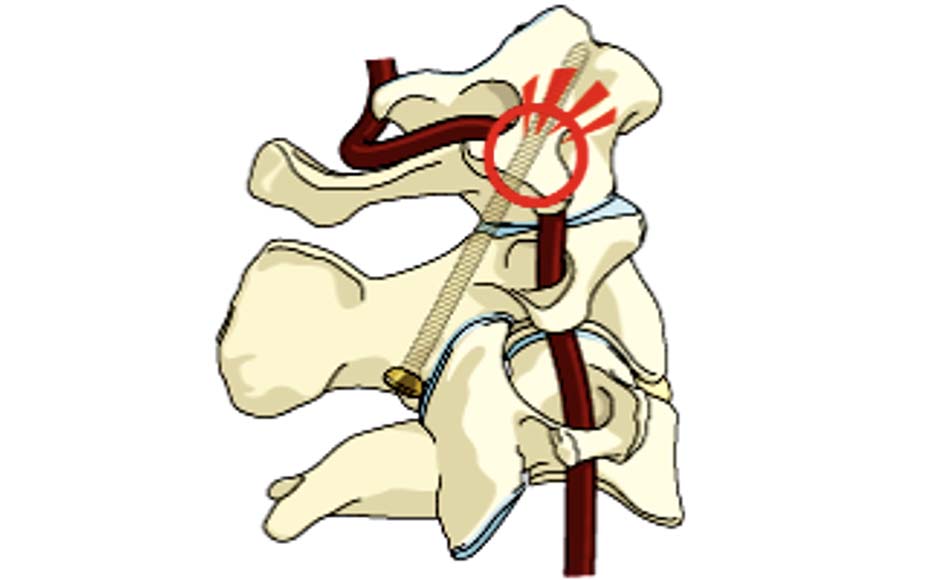
Với phẫu thuật vít qua cuống C2, một trong những vùng giải phẫu mà các phẫu thuật viên đặc biệt quan tâm là rãnh ĐMĐS ở C2. Các biến đổi giải phẫu ở vị trí này làm tăng nguy cơ tổn thương ĐMĐS và vít ra ngoài vỏ xương trong mổ. Vùng an toàn để đi vít nằm ở trên trong rãnh ĐMĐS, được xác định bằng khoảng cách từ bờ trong rãnh ĐMĐS đến ống sống (a), và khoảng cách từ bờ trên rãnh ĐMĐS đến diện khớp trên của C2 (e). Với ngưỡng cut-off là 4,5mm, có 4 typ giải phẫu rãnh ĐMĐS C2 (hình 1.10 và 1.11). Với typ II, vùng an toàn là rất hẹp, nguy cơ tổn thương ĐMĐS là rất cao khi vít qua cuống C2, ngay cả với vít 3,5mm [56].
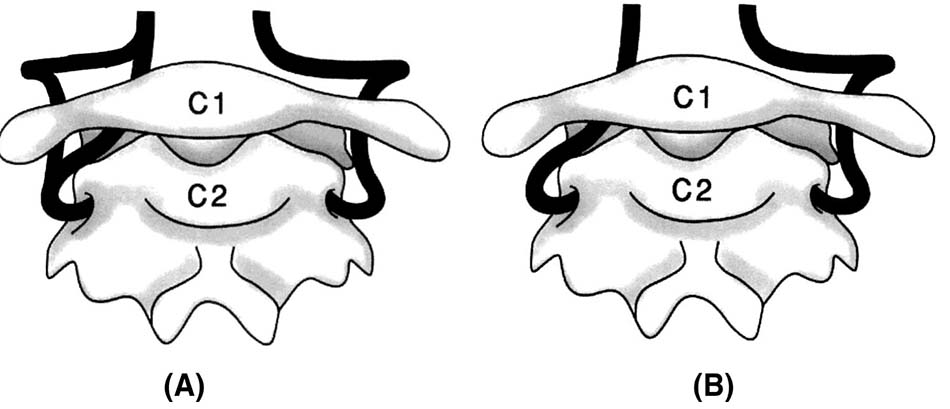
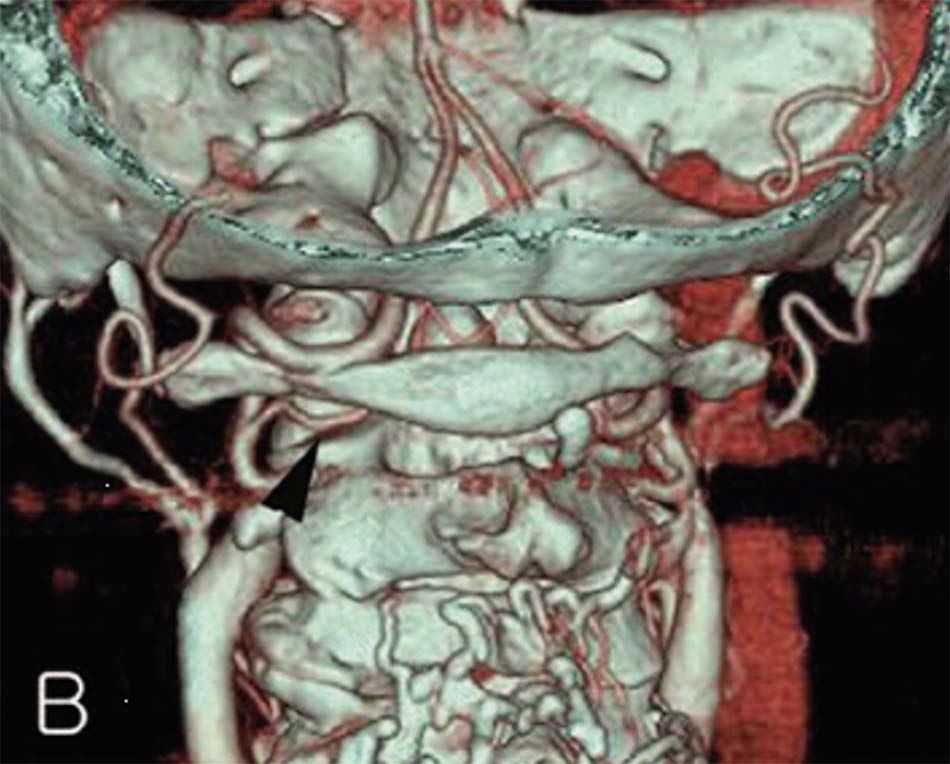
Bất thường tồn lưu ĐM bào thai không phải hiếm gặp. Trong thời kì bào thai có các vòng nối giữa tuần hoàn trước và sau, ĐM chẩm đội là một trong số đó. Sau khi thoát ra từ lỗ ngang C2, ĐM không đi vào lỗ ngang C1 mà đi vào trong ống sống, nằm cạnh cung sau C1.
ĐM tiểu não sau dưới là nhánh bên lớn nhất của ĐMĐS, nó là nhánh cấp máu quan trọng cho tiểu não. Vị trí xuất phát của ĐM thường từ bờ trên hành não. Trong một số ít trường hợp, ĐM này có thể xuất phát sớm ngang mức C1 – C2, đây là biến thể các phẫu thuật viên cần biết trước khi thực hiện các thao tác phẫu thuật ở vùng này, do nguy cơ tổn thương ĐM trong mổ có thể để lại những di chứng hết sức nặng nề [57-60].
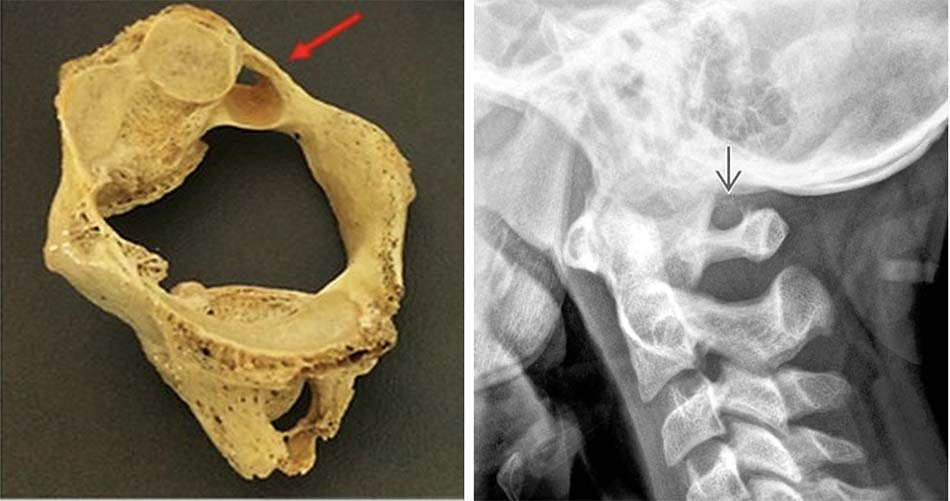
![Chiều cao eo (dấu hoa thị đơn) và chiều cao trong (dấu hoa thị đôi) đốt sống C2 [64].](https://osdbachmai.com/wp-content/uploads/2021/01/chieu_cao_eo.jpg)
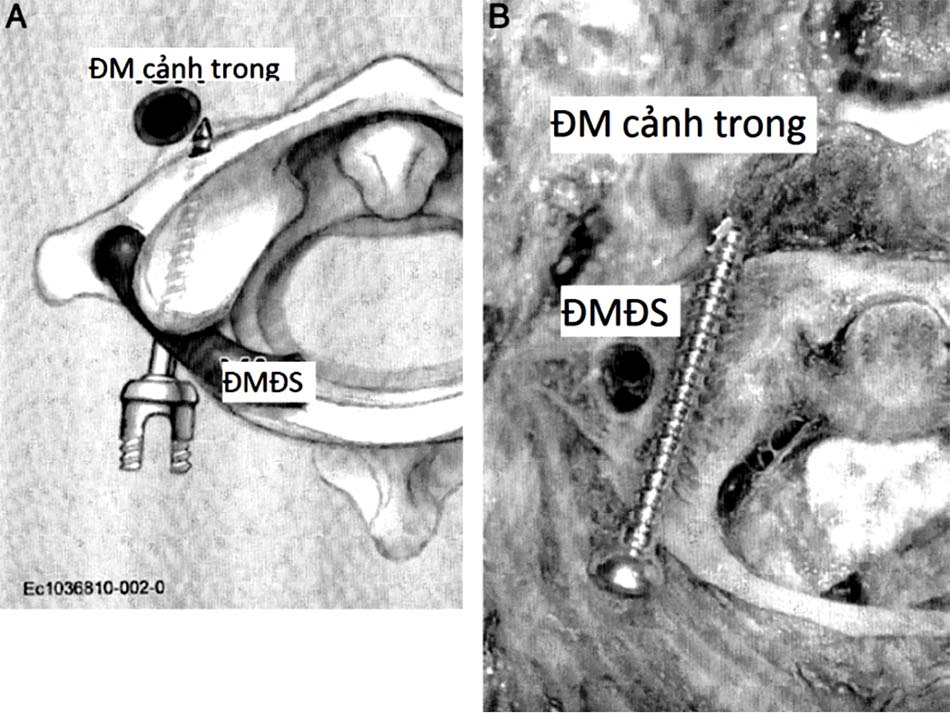
1.4.3. Tương quan giữa động mạch cảnh trong và C1 – C2
Nguy cơ tổn thương ĐM cảnh trong ở các phẫu thuật vít qua khớp C1 – C2 và vít khối bên C1 đã được đề cập trong y văn. Nghiên cứu của Currier và cộng sự đã báo cáo trường hợp tổn thương ĐM cảnh trong khi vít qua khớp C1 – C2, cũng như một số trường hợp mà khoảng cách giữa ĐM cảnh trong và đốt sống C1 chỉ là 1 m. Do vậy, việc đánh giá trước mổ khoảng cách ĐM cảnh trong- đốt sống C1, cũng như hướng đi của vít có xung đột ĐM này hay không cũng rất quan trọng [66].
II. Các tổn thương giải phẫu cột sống cổ cao
2.1. Tổn thương giải phẫu do chấn thương
2.1.1. Trật khớp chẩm – đội
Trật khớp chẩm- đội được thông báo lần đầu tiên bởi Charles Bell vào năm 1817 khi giải phẫu tử thi và mô tả lần đầu tiên trên Xquang năm 1962, trên cắt lớp vi tính năm 1983 [8],[28],[40]. Đây là thương tổn hiếm gặp, thường do chấn thương và tỉ lệ tử vong cao. Tần xuất cao hơn ở trẻ em khi bị tai nạn giao thông. Cơ chế thương tổn là do ưỡn quá mức gây tổn thương dây chằng chẩm – đội, dây chằng dọc trước và dọc sau, dây chằng nối mỏm nha với rãnh trượt. Lồi cầu chẩm trượt trên C1 ra trước hoặc sau chèn vào hành tuỷ gây ngừng thở, dẫn đến tử vong. Đôi khi tổn thương chẩm – đội do sự phối hợp của cơ chế gập và xoay [40],[42].
Năm 1989 chỉ có 21 trường hợp được thông báo trong y văn, trong đó có 4 truờng hợp tử vong do thương tổn tuỷ thứ phát, số còn lại đều có di chứng thần kinh nặng nề. Phần lớn đều được phát hiện khi mổ tử thi, Alker [7] thấy được 19/312 tử thi bị trật chẩm – đội, Bucholz [48] phát hiện được 9 ca trật chẩm – đội khi mổ 112 tử thi do chấn thương.
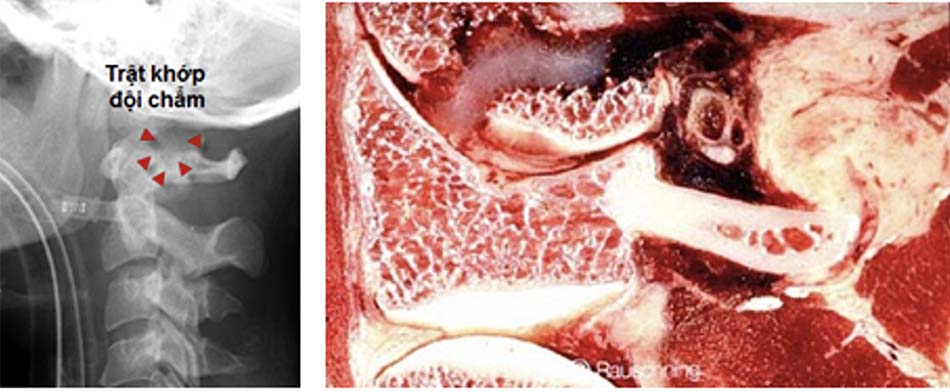
Phân loại tổn thương giải phẫu theo Anderson và Montesano [10] [23] [38]:
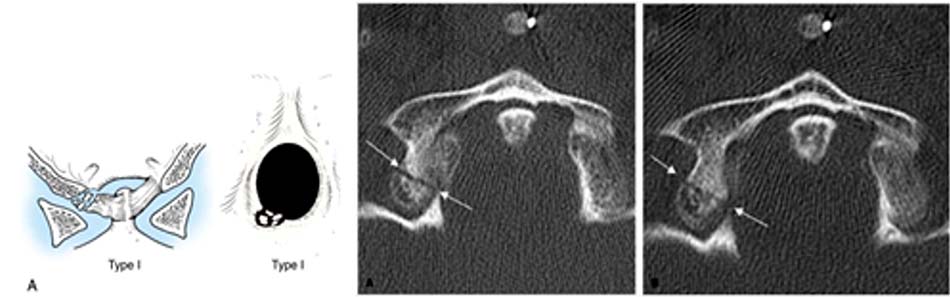
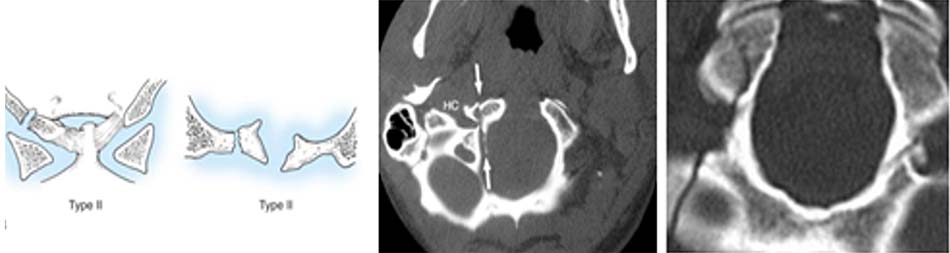
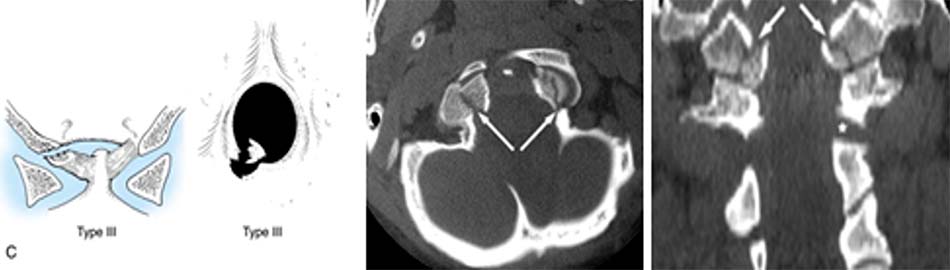
Tổn thương mất vững khi [40]:
- Vỡ lồi cầu chẩm di lệch > 5 mm,
- Tổn thương giải phẫu loại 3.
- Vỡ lồi cầu xương chẩm 2 bên.
2.1.2. Vỡ đốt đội (C1)
Vỡ C1 gặp 1-2% trong các tổn thương gãy cột sống và chiếm tỷ lệ khoảng 15% gãy cột sống cổ. Năm 1822, Cooper lần đầu tiên mô tả gãy C1 sau khi mổ tử thi. Đến năm 1920, Jefferson mô tả tổn thương vỡ C1 , là loại gãy ít gây thương tổn thần kinh do làm rộng ống tủy. Theo Sonntag và cộng sự [50], thương tổn này chiếm 3-13% trong chấn thương cột sống cổ. Theo một thông báo tổng kết từ năm 1822 đến năm 1938 có 99 thông báo đề cập đến tổn thương này [7],[48],[42].
Đây là loại thương tổn gây ra do lực nén theo trục ngang giữa lồi cầu chẩm và C2 tạo ra gãy cung trước và sau và mảnh vỡ di lệch sang bên. Thông thường di lệch sang hai bên, đôi khi di lệch một bên nếu đầu bị xoay khi bị sang chấn. Thường bệnh nhân không có tổn thương thần kinh [11] [22].
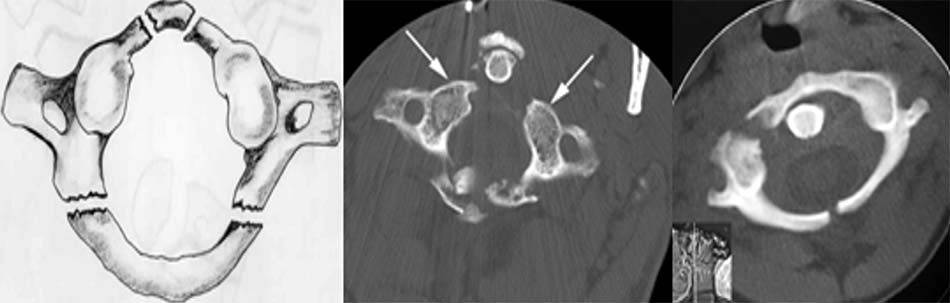
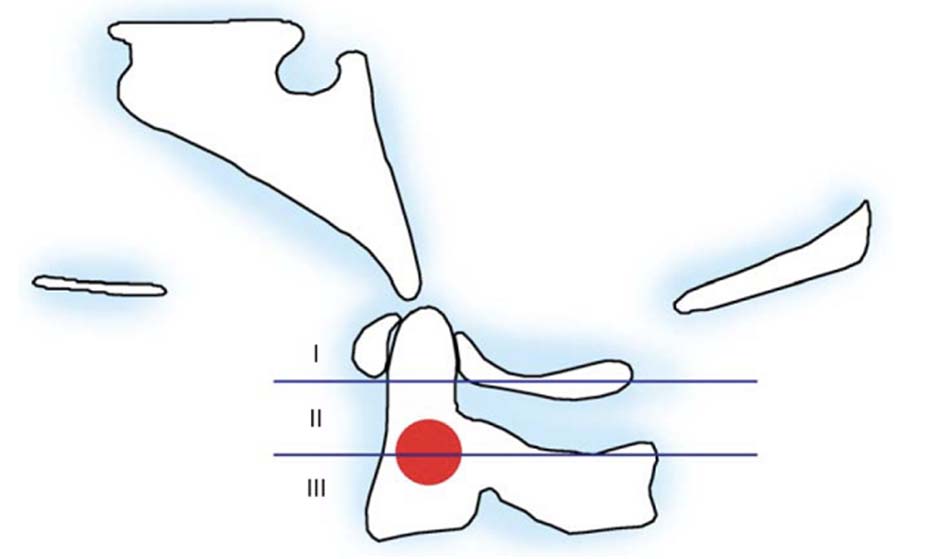
Vị trí thương tổn thường ở 4 điểm yếu ở cung trước và cung sau, nơi tiếp giáp với 2 khối bên. Có nhiều cách phân loại thương tổn, Levine và Edwards [20] phân thành 3 loại thương tổn theo vị trí và số điểm gãy trên cung trước, cung sau:
- Loại I: vỡ cung sau C1 đơn thuần, tổn thương thường gặp nhất, gãy vững, không tổn thương dây chằng ngang.
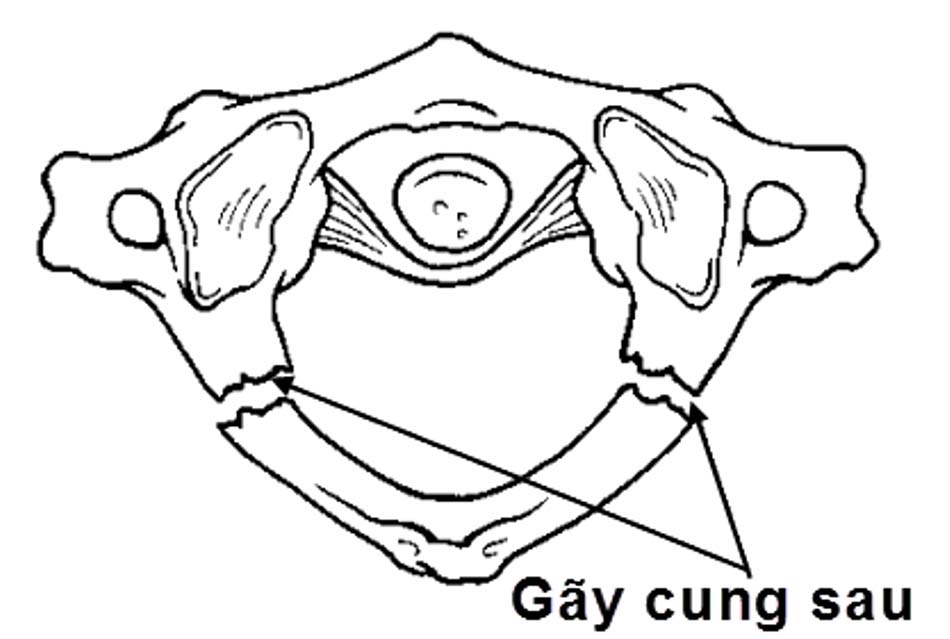
Hình 1.24. Hình ảnh vỡ cung sau C1 đơn thuần (loại 1) - Loại II: gãy kết hợp một cung trước và một cung sau do lực ép thẳng trục phối hợp với nghiêng đầu. Thương tổn ít gặp nhất của vỡ C1. Hậu quả làm bửa một khối bên C1.
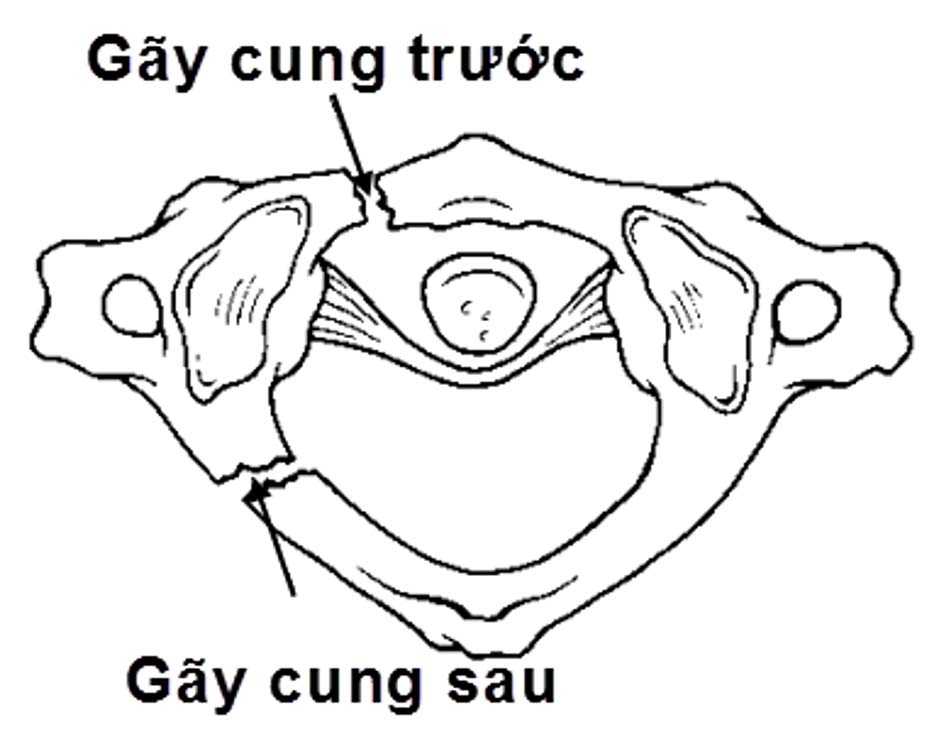
Hình 1.25. Hình ảnh vỡ cung sau C1 (loại 2) - Loại III: vỡ vụn C1 (gãy Jefferson). Tổn thương thường gặp sau gãy loại I, cơ chế do lực nén thẳng trục với tư thế đầu trung gian, tổn thương gãy 2 điểm cung trước và 1 hoặc 2 điểm ở cung sau.
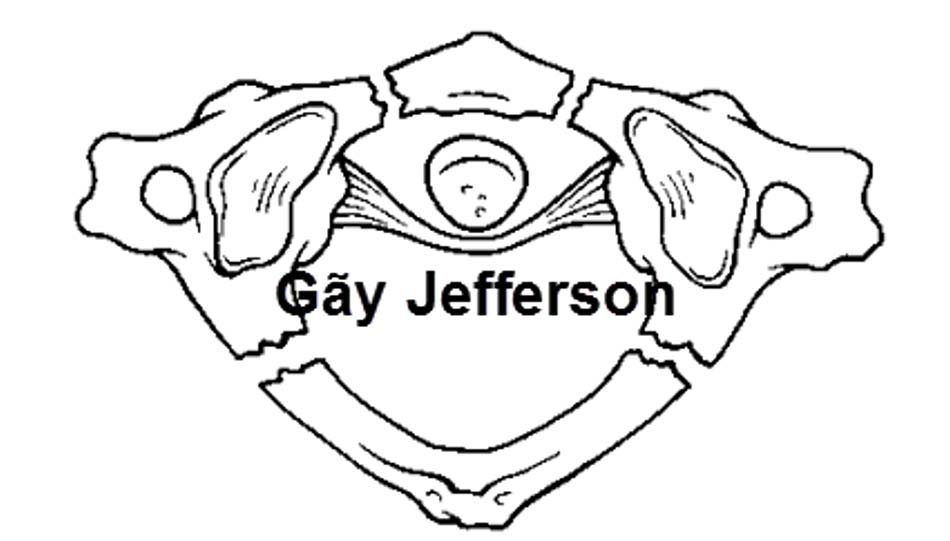
Hình 1.26. Hình ảnh vỡ vụn C1 – gãy Jefferson (loại 3)
Từ khi có chụp cắt lớp và cộng hưởng từ, người ta có thể phát hiện các thương tổn dây chằng ngang phối hợp với vỡ C1, vì vậy hầu hết đều thống nhất chia làm 2 loại:
- Vỡ C1 đơn thuần: thương tổn vững, điều trị bảo tồn.
- Vỡ C1 kèm rách dây chằng ngang: vỡ cung sau và cung trước C1 có thể làm căng rộng sang bên của hai khối bên gây rách dây chằng ngang. Spence và cộng sự [41] nghiên cứu trên tử thi thấy khi khối bên căng rộng quá 6,9 mm sẽ gây rách hoàn toàn dây chằng ngang. Đây là thương tổn mất vững và dễ di lệch thứ phát [48].
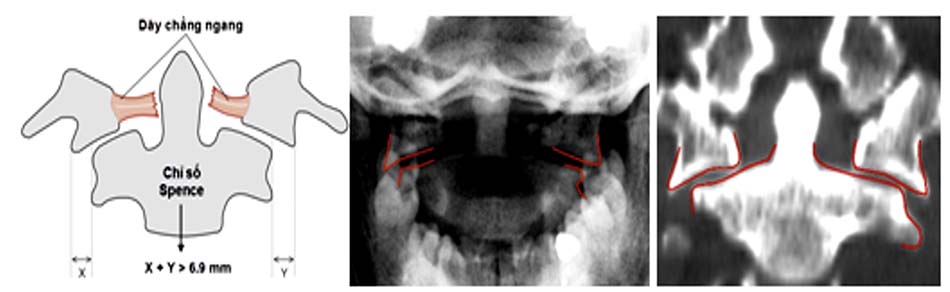
Khi chỉ số Spence > 6,9 chẩn đoán xác định đứt dây chằng ngang, tổn thương mất vững [11] [30] [42].
2.1.3. Trật khớp đội – trục (C1 – C2)
Trong khi dây chằng ngang giữ không cho C1 trượt ra trước thì dây chằng hình cánh giữ không cho khớp C1-C2 xoay quá mức. Nghiên cứu trên tử thi, Werne thấy trật xoay tới 63% là biểu hiện của trật 2 bên và làm C1 di lệch ra trước > 5mm. Khi có rách dây chằng ngang hoặc gãy mỏm nha phối hợp sẽ gây trật một bên với góc xoay 45°, khi đó C1 lệch ra trước 3-5mm [33].
Cơ chế gây trật xoay C1-C2 là phối hợp của lực xoay và gập bên. Chẩn đoán dựa vào đo khoảng cách giữa bờ trước mỏm nha và bờ sau cung trước C1 (ADI – atlantodens interval), bình thường ADI < 3mm ở người lớn và ADI < 5mm ở trẻ em [24],[42],[33].
Nguyên nhân thường gặp trật C1-C2 [12],[17],[29],[45]:
- Đứt dây chằng ngang.
- Gãy mỏm nha.
- Gãy Jeffeson mất vững.
- Mất vững cổ – chẩm (đứt dây chằng cánh).
- Khớp giả mỏm nha (chấn thương, thiểu sản mỏm nha).
Dựa trên hình ảnh Xquang, cắt lớp vi tính và cơ chế tổn thương, Fielding chia trật C1-C2 thành 4 loại [42]:
- Loại 1: trật nhẹ diện khớp, ADI < 3mm.
- Loại 2: đứt dây chằng ngang, ADI: 3 – 5 mm.
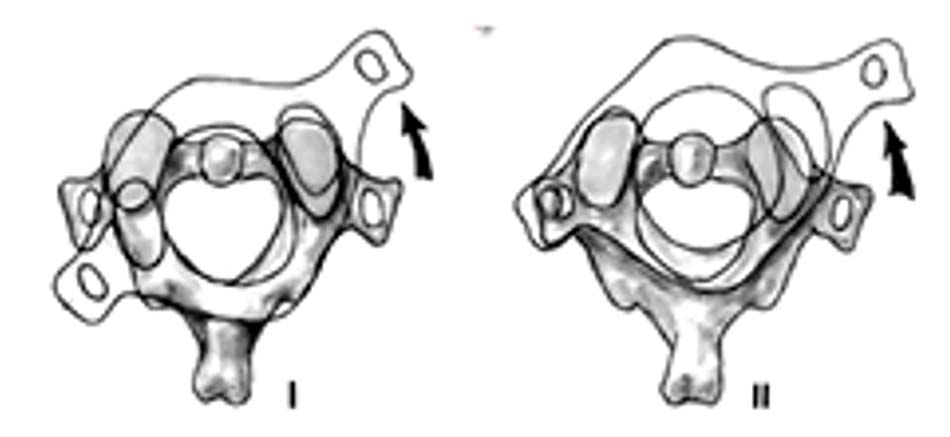
Hình 1.28. Trật C1-C2 loại 1 và 2 - Loại 3: đứt dây chằng ngang, dây chằng cánh, ADI > 5mm.
- Loại 4: trật C1 ra sau so với C2, thường phối hợp gãy mỏm nha hoặc vỡ cung trước C1.
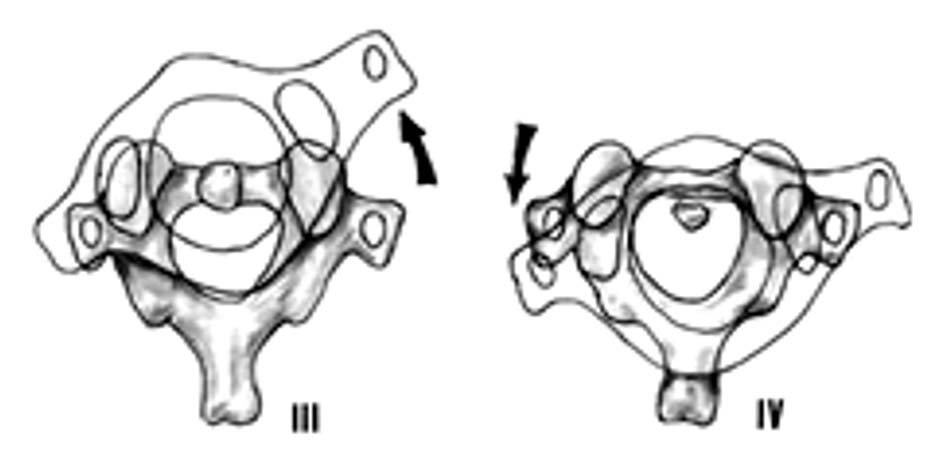
Hình 1.29. Trật C1-C2 loại 3 và 4
2.1.4. Gãy mỏm nha
Chiếm 10-15 % tổn thương cột sống cổ và 75% chấn thương cột sống cổ ở trẻ em, gặp ở nhiều nhóm tuổi. Cơ chế tổn thương do ép đứng dọc phối hợp với lực di lệch ngang [24],[42]. Althoff cho rằng gãy mỏm nha là hậu quả của lực ép quanh trục phối hợp lực trượt đứng thẳng [47]. Theo một nghiên cứu khác thì gãy mỏm nha di lệch ra trước gấp 7 lần di lệch ra sau. Dây chằng cũng đóng vai trò quan trọng, trong đó dây chằng cánh và dây chằng dọc trước thường phối hợp với gãy mỏm nha [27],[35]. Năm 1974, Anderson và D’Alonzo mổ tả tổn thương thành 3 loại dựa trên phân tích 60 bệnh nhân gãy mỏm nha từ năm 1964 đến 1972 [42]:
- Loại 1: Gãy chéo qua đỉnh, tổn thương vững, điều trị bảo tồn thường không để lại di chứng (gãy chỏm).
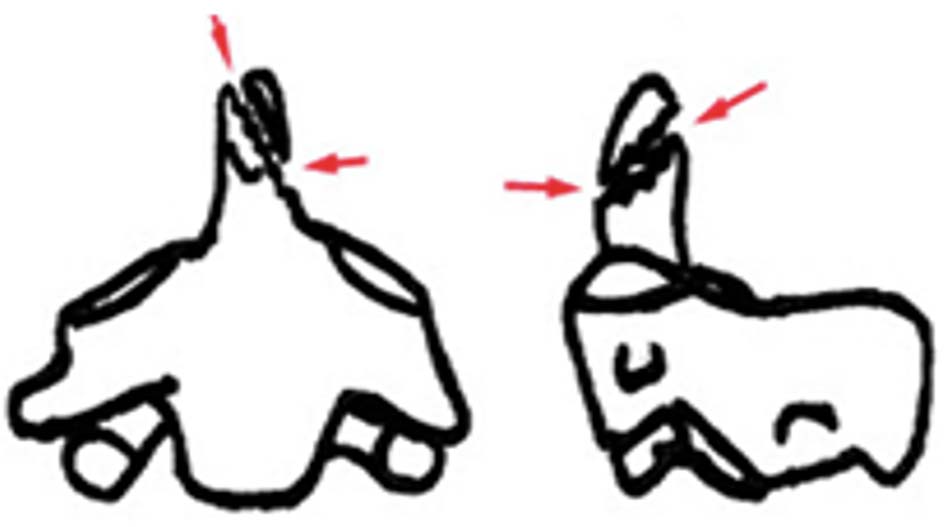
Hình 1.30. Gãy mỏm nha loại 1. - Loại 2: Gãy qua nền mỏm nha, nơi tiếp giáp giữa mỏm nha và thân C2. Là tổn thương thường gặp nhất, loại gãy này tỉ lệ khớp giả cao khoảng 65%, nguyên nhân do vùng này cấp máu kém [24]. Theo Roy – Camille, có tới 40% thuộc loại này để lại di chứng khớp giả nếu điều trị bảo tồn. Trong nhóm này, Hadley xếp những trường hợp có mảnh rời ở nền mỏm răng vào loại 2A và cho đó chính là nguyên nhân thất bại trong điều trị bảo tồn [50].
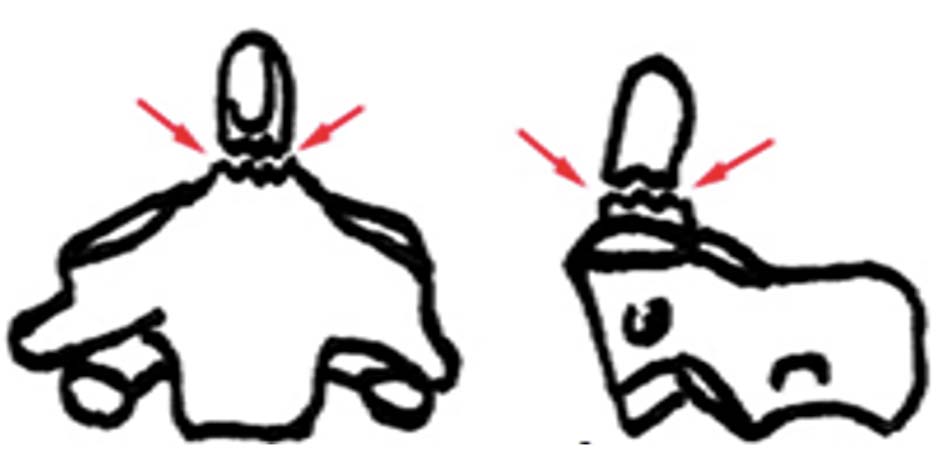
Hình 1.31. Gãy mỏm nha loại 2 - Loại 3: Đường gãy chéo qua thân C2, điều trị bảo tồn tỷ lệ liền xương cao. Năm 1974, Roy – Camille phân loại theo hướng của đường gãy giúp cho hướng phẫu thuật thích hợp: đường gãy chéo xuống, di lệch ra trước, đường gãy chéo xuống, di lệch ra sau, đường gãy ngang.
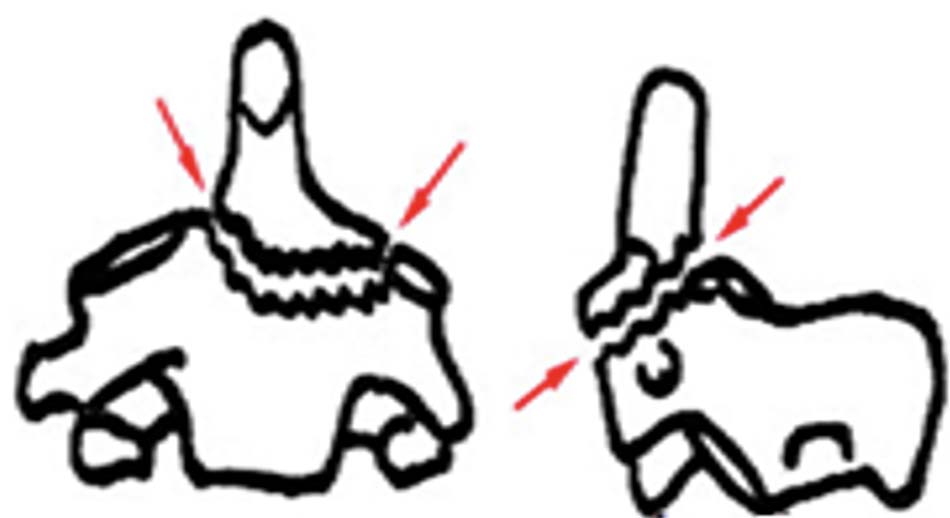
Hình 1.32. Gãy mỏm nha loại 3
2.1.5. Gãy C2 (gãy Hangman)
Gãy Hangman được Wood – Jones mô tả đầu tiên vào năm 1913 ở những nạn nhân bị kết án treo cổ. Theo một số nghiên cứu, gãy Hangman chiếm tỉ lệ 12-18% trên tổng số gãy cột sống cổ, 25 – 40% trong số này chết sau tai nạn, số còn lại chỉ có từ 3 – 10% có tổn thương thần kinh.
Gãy Hangman là sự phối hợp của cơ chế ưỡn quá mức và dồn ép chủ yếu do tai nạn giao thông, đường gãy qua 2 chân cuống với giật đứt C2. Khi cơ chế ưỡn chiếm ưu thế, dây chằng dọc trước bị rách kèm đứt kèm theo đứt mảnh xương nhỏ ở vành ngoài của C2 hoặc C3. Khi ưỡn nhiều hơn làm rách cả đĩa đệm và dây chằng dọc sau làm thân C2 trật ra trước gây mất vững. Tuy nhiên cung sau C2 vẫn ở nguyên vị trí vì chân cuống bị gãy hai bên, ống tuỷ được mở rộng ra và không gây thương tổn tuỷ [38],[42].
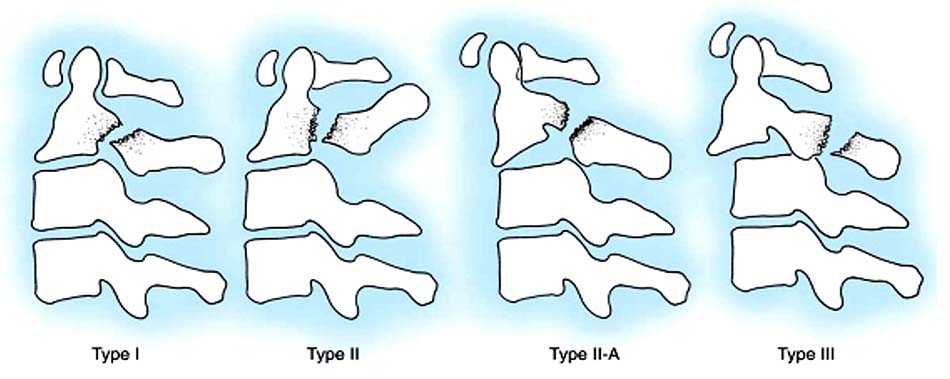
Có nhiều cách phân loại gãy Hangman, thông dụng nhất là phân loại của Effendi và cộng sự, sau này được Levine và Edwards thay đổi [37].
- Loại I: Gãy ngang qua diện khớp hai bên hoặc ở đoạn trên hay dưới diện khớp, di lệch dưới 3mm, không gập góc. Loại này hay phối hợp các thương tổn khác như gãy cung sau C1, gãy Jefferson, gãy mỏm nha.
- Loại II: Di lệch trên 3mm, gập góc tì lên góc trên trước C3.
- Loại IIA: Gập góc nhưng không di lệch hoặc lệch không đáng kể. Trong loại này dây chằng dọc sau và đĩa đệm rách.
- Loại III: Di lệch và gập góc nhiều, kèm trật khớp C2-C3 một hay hai bên. Dây chằng dọc trước và sau rách hoàn toàn.
2.2. Tổn thương trật đội – trục do viêm khớp dạng thấp
Biểu hiện lâm sàng viêm khớp dạng thấp lần đầu tiên được mô tả vào năm 1800 bởi Landre – Bouvais tại bệnh viện Salpetrière, Paris. Năm 1859, Garrod đặt tên cho bệnh này và tới năm 1890 ông đã thông báo 36% bệnh nhân viêm khớp dạng thấp có tổn thương cột sống cổ. Waaler (năm 1940) và Rose (năm 1948) đã tìm ra yếu tố dạng thấp [32].
Trong quá trình tiến triển, 83% bệnh nhân có tổn thương khớp đội – trục bắt đầu vào năm thứ hai của bệnh. Tùy theo thời gian mắc bệnh, tần suất gặp tổn thương khớp đội – trục trên chẩn đoán hình ảnh cột sống cổ chiếm 43-86% [32].
Cơ chế của quá trình trật C1-C2 ra trước do quá trình ăn mòn bao hoạt dịch, xương và hệ thống dây chằng kết hợp với sức nặng của hộp sọ và các cử động khớp C1-C2. Tuy nhiên biểu hiện lâm sàng không rõ ràng, thường triệu chứng xuất hiện sau khoảng 10 năm hoặc hơn sau đó. Bất cứ một khớp hoạt dịch nào trong cơ thể đều có thể bị tổn thương, nhưng sự thay đổi sớm nhất lại xảy ra ở hệ thống khớp C1-C2 [15],[31],[33],[45],[53].
Weissmann và cộng sự nghiên cứu hồi cứu 194 bệnh nhân thấy rằng chèn ép tuỷ xuất hiện khi khoảng cách trật bên C1-C2 trượt ra trước khoảng 9 mm. Gần đây Boden và cộng sự nghiên cứu trên 73 bệnh nhân phát hiện ra kích thước còn lại của tuỷ sống nếu còn 14 mm hoặc nhỏ hơn sẽ xuất hiện các thương tổn thần kinh. Sự tổn thương đứt gãy của dây chằng ngang cũng là nguyên nhân gây trượt C1-C2 [45].
Pellicci và cộng sự nghiên cứu trong 5 năm với 106 bệnh nhân viêm khớp dạng thấp cho thấy 80% bệnh nhân này có tổn thương trên Xquang khớp C1-C2 với hình ảnh thoái hoá rõ ràng, sau 5 năm 36% có tiến triển nặng lên và xuất hiện tổn thương về thần kinh. Marks và Sharp mô tả 31 bệnh nhân có tổn thương trật C1-C2 có hẹp ống sống cổ, 50 % chết trong vòng 6 tháng và đều nằm trong nhóm không được điều trị gì [32].
Một nghiên cứu khác trên 104 bệnh nhân cho thấy có 11 bệnh nhân trong số này là tổn thương trật C1-C2 và có chèn ép tuỷ, 7/11 trường hợp này chết đột tử, nghiên cứu cho thấy trật C1-C2 có chèn ép tuỷ chiếm khoảng 10%.
2.3. Mất vững đội – trục do các dị dạng bẩm sinh
Các dị tật bẩm sinh cột sống cổ thường ít gặp nhưng ảnh hưởng lớn đến người bệnh. Các bất thường cấu trúc cột sống cổ xảy ra trong giai đoạn sớm của quá trình phát triển bào thai. Khi các dị tật này được phát hiện trong thời kỳ thiếu nhi, thường có biểu hiện ổn định, không tiến triển. Nhiều dị tật không được phát hiện cho đến khi có biến chứng. Tuy nhiên, các dị tật này có thể diễn biến xấu đi gây nguy hiểm tính mạng [12],[13],[29].
Biến dạng cột sống gây khó khăn trong thăm khám chẩn đoán hình ảnh tiêu chuẩn. Các tư thế chụp không tiêu chuẩn và chụp góc chéo có thể làm chẩn đoán khó khăn hơn và ảnh hưởng tới đánh giá toàn diện trên bệnh nhân. Chụp Xquang động, chụp cắt lớp vi tính, chụp cộng hưởng từ, chụp mạch là các biện pháp cần thiết để đánh giá tổn thương.
Nguyên nhân gây mất vững đội – trục do: thiểu sản mỏm nha hoặc giãn dây chằng ngang đốt đội [12].
2.3.1. Mất vững đội – trục do bất thường mỏm nha
Mỏm nha đóng vai trò như chốt hãm để hạn chế quá ưỡn, tầm vận động bình thường được duy trì phụ thuộc vào cấu trúc dây chằng và bao khớp [36].
Tổn thương hiếm gặp, thường thấy ở những bệnh nhân mắc bệnh Down. Các dị tật bẩm sinh mỏm nha có thể dẫn đến mất vững đội – trục, làm tổn thương thần kinh, thậm chí tử vong do chèn ép tủy sống [12],[51].
Spitzer và cộng sự đã mô tả mất vững khớp chẩm – đội và thiểu sản đốt đội trong hội chứng Down [12]. Phân loại dị tật mỏm nha chia ra:
- Không có mỏm nha: là dị tật mỏm nha không phát triển, trên Xquang thường quy không có mỏm nha.
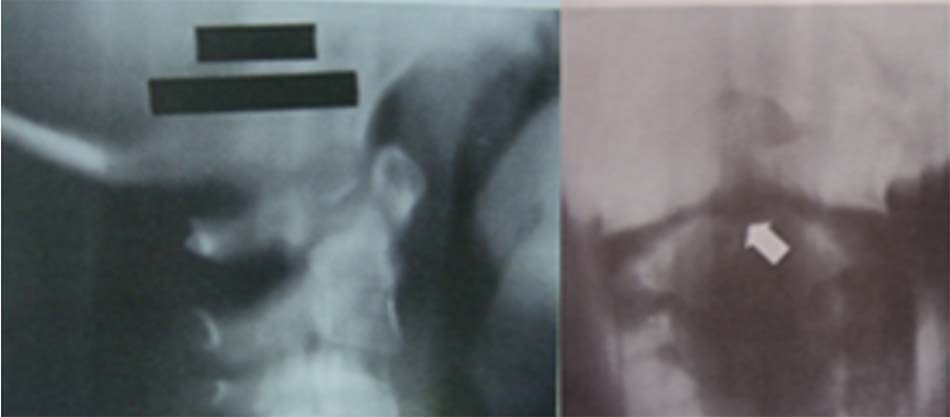
Hình 1.35. Hình ảnh Xquang không có mỏm nha. - Thiểu sản mỏm nha: mỏm nha phát triển bán phần, có hình dạng khác nhau có thể là 1 mẩu ngắn hoặc có thể có kích thước gần như bình thường.
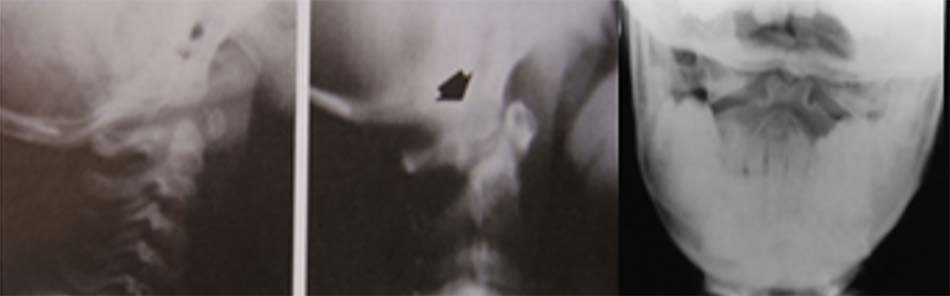
Hình 1.36. Thiểu sản mỏm nha trên Xquang - Khớp giả mỏm nha: Mỏm nha được chia làm 2 đoạn, trong đó có một đoạn tách rời.
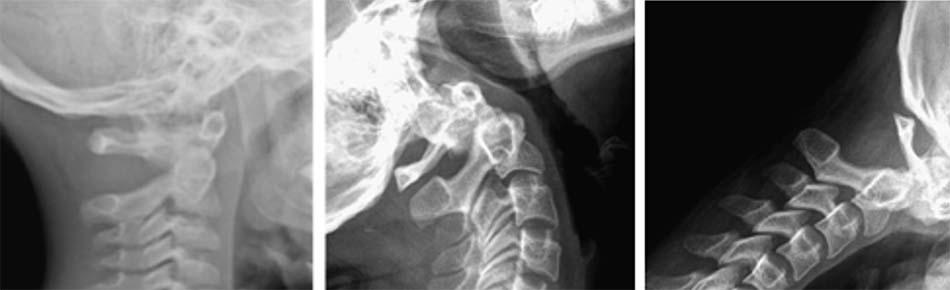
Hình 1.37. Mất vững C1-C2, khớp giả mỏm nha trên Xquang thường quy 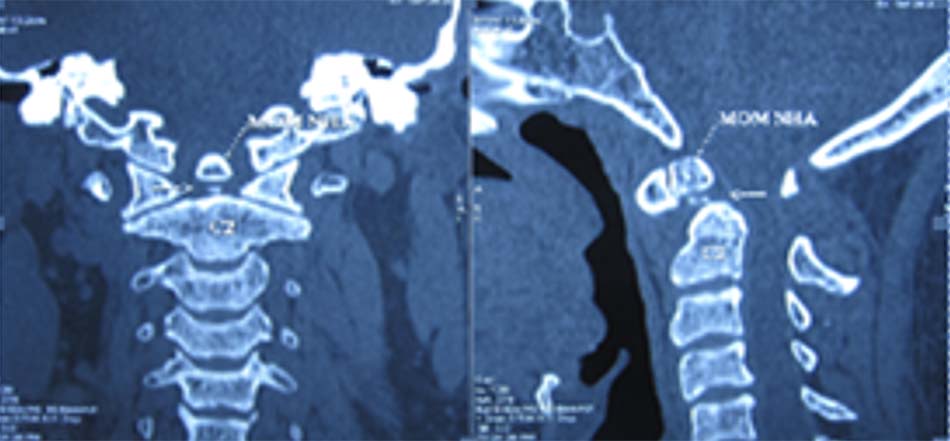
Hình 1.38. Khớp giả mỏm nha trên cắt lớp vi tính (hội chứng Down).
Tình trạng yếu dây chằng toàn thể kết hợp với tình trạng diện khớp bên nông làm cho khớp tăng động và có các vận động bệnh lý ở vùng cổ chẩm và khớp đội – trục, 10 – 40% số bệnh nhân này có dấu hiệu X.Quang thể hiện mất vững vùng đội trục. Diễn biến bệnh lý mất vững đội trục của bệnh nhân có hội chứng Down chưa được xác định rõ. Lâm sàng chưa chứng minh được mối liên quan giữa tiến triển thần kinh và mất vững đội trục ở người mắc bệnh Down [12],[36].
Lâm sàng mất vững khớp đội trục do các loại dị tật mỏm nha đều giống nhau, khác nhau của các dị tật này là tổn thương trên chẩn đoán hình ảnh, do vậy phân biệt các tổn thương dị tật của mỏm nha không quan trọng. Các dị tật này đều dẫn đến mất vững đội trục và phương pháp điều trị đều giống nhau. Tần suất gặp của dị tật này chưa được nghiên cứu. Các trường hợp phát hiện được thường là phối hợp chấn thương hoặc có triệu chứng lâm sàng đòi hỏi phải chụp phim. Các nghiên cứu cho thấy, mỏm nha bất thường có cấu trúc ngắn và thân bè hoặc chỉ là một di tích mỏm nha ở khu vực mỏm nha. Thiểu sản hoặc khớp giả mỏm nha có thể do thứ phát sau chấn thương và hiếm gặp hơn do nhiễm trùng. Nhiều trường hợp gặp khớp giả mỏm nha sau chấn thương đã được ghi lại trên y văn [12],[13],[29].
Fielding và cộng sự đưa ra bằng chứng cho rằng các gãy xương không được phát hiện ở khu vực nền mỏm nha là nguyên nhân thường gặp hơn nguyên nhân bẩm sinh. Các tác giả trên cho rằng sau gãy xương, có thể mảnh mỏm nha chưa di lệch nhiều nhưng về sau do co rút của dây chằng cánh, mảnh vỡ bị di lệch về vùng chẩm. Nguồn cấp máu cho mỏm nha không nhiều vì mạch cấp máu đi dọc theo mỏm nha và dễ bị tổn thương. Điều này giải thích hiện tượng chậm liền và khớp xơ làm co kéo mỏm nha. Vị trí của mỏm nha nằm trong vòng C1 được duy trì bằng dây chằng ngang đốt đội. Cấp máu cho mảnh vỡ là cung động mạch cổ lên, đi từ động mạch cảnh qua dây chằng cánh. Cấp máu này chỉ đủ cho một phần của mỏm nha. Nguồn cấp máu này có thể dễ dàng bị tổn thương do kéo giãn các dây chằng [12].
Quan điểm về các bất thường xương kèm theo thiểu sản mỏm nha hoặc khớp giả mỏm nha chưa được thống nhất. Cung sau C1 có thể bị thiểu sản hoặc cung trước bị phì đại. Tăng kích thước của cung trước C1 có thể là dấu hiệu hữu ích cho thấy tình trạng bệnh lý mãn tính của C1-C2. Nếu cung sau C1 hẹp và có di lệch bất thường của C1, ống sống sẽ bị thu hẹp và tăng nguy cơ chèn ép.
Trong khớp giả mỏm nha, giữa mỏm nha và thân đốt trục có hình ảnh giống một khe khớp nhìn trên phim xquang. Phân biệt hình ảnh khớp giả này với khớp bán động sụn trung tâm thường gặp ở trẻ dưới 5 tuổi. Vì vậy, đối với trẻ dưới 5 tuổi, chẩn đoán khớp giả mỏm nha được xác định bằng sự di lệch của mỏm nha và thân đốt trục trên hình ảnh phim Xquang động.
Ở người lớn, chẩn đoán khớp giả mỏm nha có thể qua Xquang với hình ảnh khe khớp giữa mỏm nha và thân đốt trục. Khe khớp ở khớp giả mỏm nha giữa mảnh tự do và đốt trục thường nằm cao hơn vị trí của diện khớp đội – trục bên và có đường viền nhẵn. Mảnh rời thường có kích thước bằng 1/2 kích thước mỏm nha bình thường, hình tròn hoặc bầu dục, vỏ xương dày.
Khớp giả do chấn thương đường khe khớp hẹp, bất thường và đường gãy thường kéo dài đến thân đốt đội, dưới diện khớp đội – trục bên. Mảnh rời mỏm nha liền với phần trước của đốt đội và di chuyển theo vận động ngửa, gập hoặc nghiêng cổ hai bên.
Đường đo được kẻ dọc theo mặt trên từ bờ sau của đốt trục và đường kẻ dọc theo mặt dưới từ bờ sau của cung trước đốt đội. Khoảng cách lớn hơn 3mm được coi là bệnh lý. Trong nghiên cứu của Fielding và cộng sự, khoảng cách trên là 1 cm và hầu hết bệnh nhân có mất vững trước hoặc sau hoặc đa hướng. Mất vững đa hướng đồng nghĩa với khớp C1-C2 không ổn định.
Watanabe và cộng sự thấy rằng bệnh nhân có xoay trên 20 độ trên mặt phẳng dọc giữa sẽ có tỷ lệ bệnh lý tủy cao hơn (86%) và các bệnh nhân có bệnh lý tủy có tỷ lệ mất vững cao hơn (40%). Độ xoay càng lớn thì nguy cơ ép tủy càng cao [52].
Phẫu thuật cố dịnh dự phòng chưa được thống nhất. Nếu chúng ta thấy có mất vững hoặc có bất thường về triệu chứng thần kinh, phẫu thuật hàn khớp cần được chỉ định. Phẫu thuật nắn chỉnh nên tránh và cần chỉ định nắn chỉnh qua kéo sọ trước mổ. Phẫu thuật cố định vùng sau C1-C2 đơn thuần thường được chỉ định nếu không cần gập cổ. Hàn chẩm C2 cũng có thể có chỉ định để tránh các sang chấn thần kinh trong quá trình phẫu thuật.
2.3.2. Giãn dây chằng ngang đốt đội
Giãn dây chằng ngang đốt đội cần được nghĩ tới khi có trật khớp đội trục mãn tính mà không có tác động chấn thương, dị tật bẩm sinh, nhiễm trùng hoặc viêm khớp dạng thấp và chẩn đoán hình ảnh có tổn thương mất vững đội – trục. Giãn dây chằng ngang đốt đội thường gặp trên bệnh nhân có hội chứng Down, tỷ lệ khoảng 15% [12].
Tổn thương có thể gặp trên nhiều nhóm tuổi, dây chằng ngang đứt hoặc yếu dẫn đến trật C1-C2, làm hẹp ống tủy, gây chèn ép thần kinh. Giai đoạn đầu tủy chưa bị chèn ép do vai trò của dây chằng cánh.
Nhiều trường hợp có tăng ngưỡng vận động nhưng không biểu hiện triệu chứng lâm sàng mà tổn thương chỉ được phát hiện dựa vào chẩn đoán hình ảnh. Trên Xquang khoảng đội – nha (ADI) lớn hơn 5mm đồng nghĩa với mất vững đội trục. Khi xuất hiện triệu chứng lâm sàng, độ mất vững sẽ hơn 7mm thậm chí 10 mm. Chẩn đoán xác định giãn dây chằng ngang dựa vào chụp cộng hưởng từ.
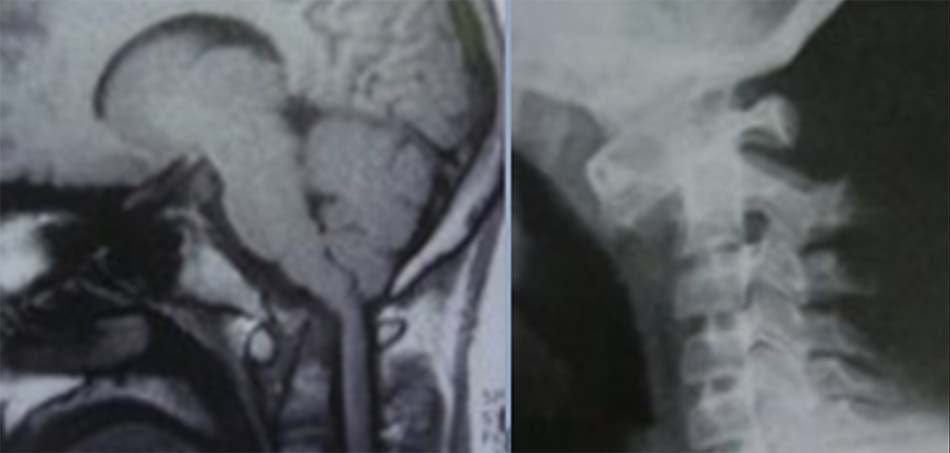
Đánh giá bằng chẩn đoán hình ảnh cần phải được tiến hành thường quy đối với các trường hợp hội chứng Down. Các bệnh nhân có mất vững đội trục và không có triệu chứng thần kinh cũng nên tránh các môn thể thao có tác động lên cột sống. Ủy ban Olympic đặc biệt đã liệt kê các môn thể thao như thể dụng dụng cụ, nhảy cao, nhảy cầu, bơi bướm và bơi ếch cũng như là chạy việt dã là các môn thể thao bệnh nhân cần tránh. Sử dụng nẹp cổ vẫn chưa có thống nhất trong chỉ định. Mất vững tiến triển kết hợp triệu chứng lâm sàng thần kinh cần được chỉ định phẫu thuật.
2.4. Các tổn thương gây mất vững khác
2.4.1. Tật lồng đáy sọ
Tật lồng đáy sọ là bất thường vùng cổ chẩm có nguy cơ gây tử vong cao do mất vững đội – trục và có thể gây trật đội – trục khi chỉ gặp chấn thương nhỏ. Điều trị phẫu thuật gặp nhiều khó khăn. Nhiều quan điểm cho rằng chèn ép thân não phía trước nên được giải ép bằng đường mổ lối trước qua khoang miệng và sau đó nẹp cổ chẩm. Trong dị dạng Chiari, có thể phẫu thuật giải ép mai chẩm và cố định cổ chẩm [4]. Phương pháp khác đã được áp dụng khi phẫu thuật can thiệp làm giãn khớp đội – trục và vít khối bên [2]. Một nghiên cứu tiến hành trên 190 bệnh nhân tật lồng đáy sọ do Goel và cộng sự tiến hành nhằm đánh giá sự thích hợp trong phương pháp phẫu thuật. Dựa vào sự kết hợp với dị dạng Chiari, tật lồng đáy sọ được chia vào 2 nhóm bao gồm không có sự kết hợp với dị dạng Chiari hoặc có Chiari. Với những bệnh nhân tật lồng đáy sọ không có Chiari kèm theo thích hợp hơn khi được phẫu thuật giải ép đường miệng và nếu có Chiari kèm theo thì phải giải ép lỗ chẩm. Sau phẫu thuật giải ép lối trước ở những bệnh nhân không có Chiari nên được cố định cổ chẩm tuy nhiên tỷ lệ cố định cổ chẩm ở nhóm giải ép lỗ chẩm trong Chiari hạn chế hơn [3].
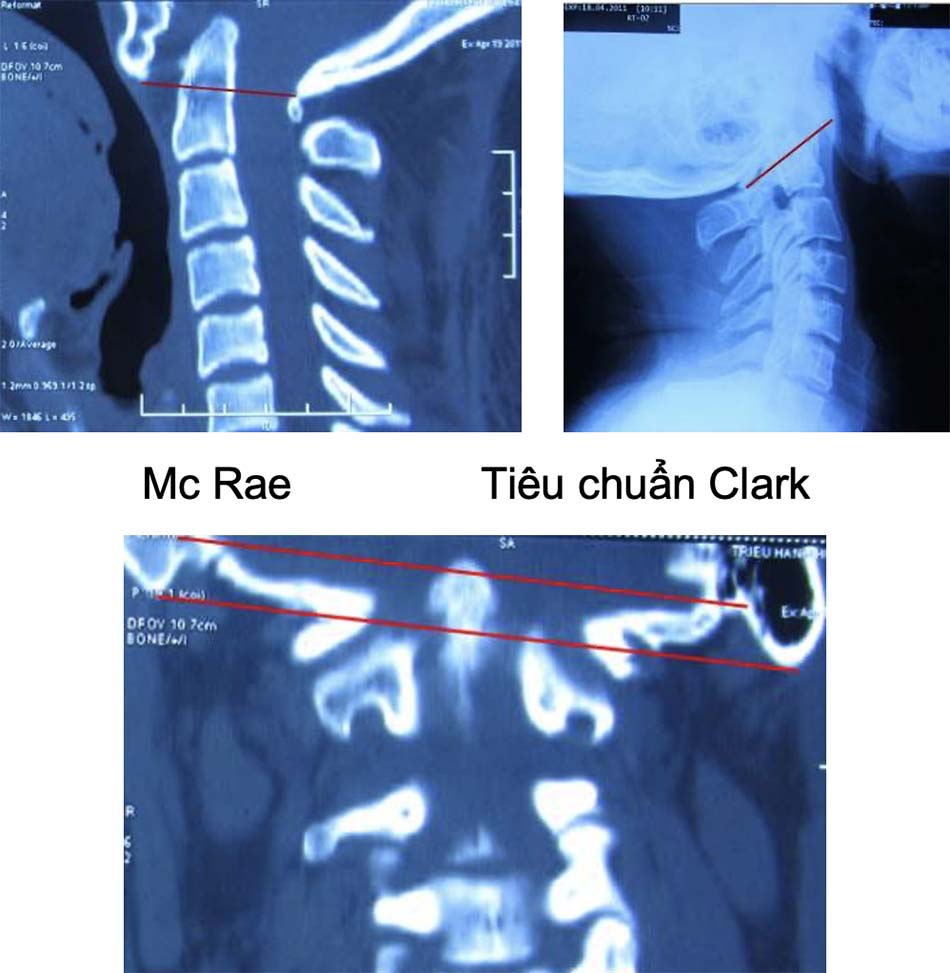
Chẩn đoán Tật lồng đáy sọ được xác định trên chẩn đoán hình ảnh [1], có 3 đường cơ bản được xác định trên phim chụp nghiêng và đường trên phim chụp thẳng như sau:
- Đường Chamberlain: nối từ bờ dưới lỗ chẩm tới bờ dưới khẩu cái cứng. Triệu chứng lâm sàng xuất hiện khi đỉnh mỏm nha nằm phía trên đường kẻ này. Tuy nhiên điều bất lợi khi xác định đường Chamberlain do bờ dưới lỗ chẩm khó xác định trên phim nghiêng.
- Đường McGregor: nối từ điểm thấp nhất của vòng cung chẩm tới bờ trên thành sau khẩu cái cứng, nếu đỉnh mỏm nha nằm trên đường này 4,5 mm, có sự bất thường.
- Đường Mc Rae: bản chất là đường kính lỗ chẩm, đường nối từ bờ trước đến bờ sau lỗ chẩm. Không có triệu chứng lâm sàng nếu đỉnh mỏm nha nằm dưới đường này.
![Tật lồng đáy sọ trên cắt lớp vi tính và cộng hưởng từ [1]](https://osdbachmai.com/wp-content/uploads/2021/01/tat_long_day_so.jpg)
Đường Fischgold and Metzger: xác định trên phim thẳng trước sau là đường thẳng nối 2 điểm giữa chân mỏm chũm và nền sọ, bình thường đường này nằm phía trên đỉnh mỏm nha 10,7 mm và trên khớp đội chẩm 11,6 mm. Nếu khoảng cách này ngắn lại chẩn đoán xác định dị dạng lồng đáy sọ.
![Đường Fischgold and Metzger [1]](https://osdbachmai.com/wp-content/uploads/2021/01/Fischgold_and_Metzger-.jpg)
Khi chẩn đoán tật lồng đáy sọ trên chẩn đoán hình ảnh nhưng chưa có triệu chứng lâm sàng, điều trị bảo tồn được đặt ra với các thuốc NSAIDs, kéo giãn cột sống cổ và nẹp cổ.
2.4.2. Các tổn thương do khối u tủy, ung thư hoặc di căn
Bên cạnh các tổn thương do chấn thương đã mô tả, các tổn thương do khối u phát triển tại chỗ hoặc do di căn vào các cấu trúc cột sống C1-C2 gây mất vững cũng thường gặp. Với các tổn thương này thường gây phá hủy cấu trúc xương cùng với phần mềm, vì vậy chỉ định nẹp cổ chẩm hay được chỉ định trong phẫu thuật nhằm làm vững cột sống sau phẫu thuật giải phóng chèn ép và lấy u.
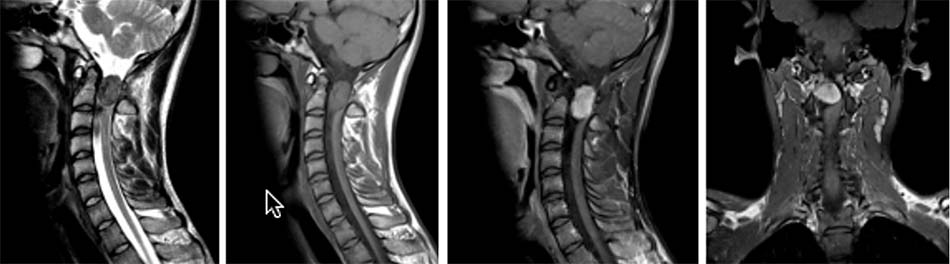
2.4.3. Các tổn thương do viêm, lao, nấm
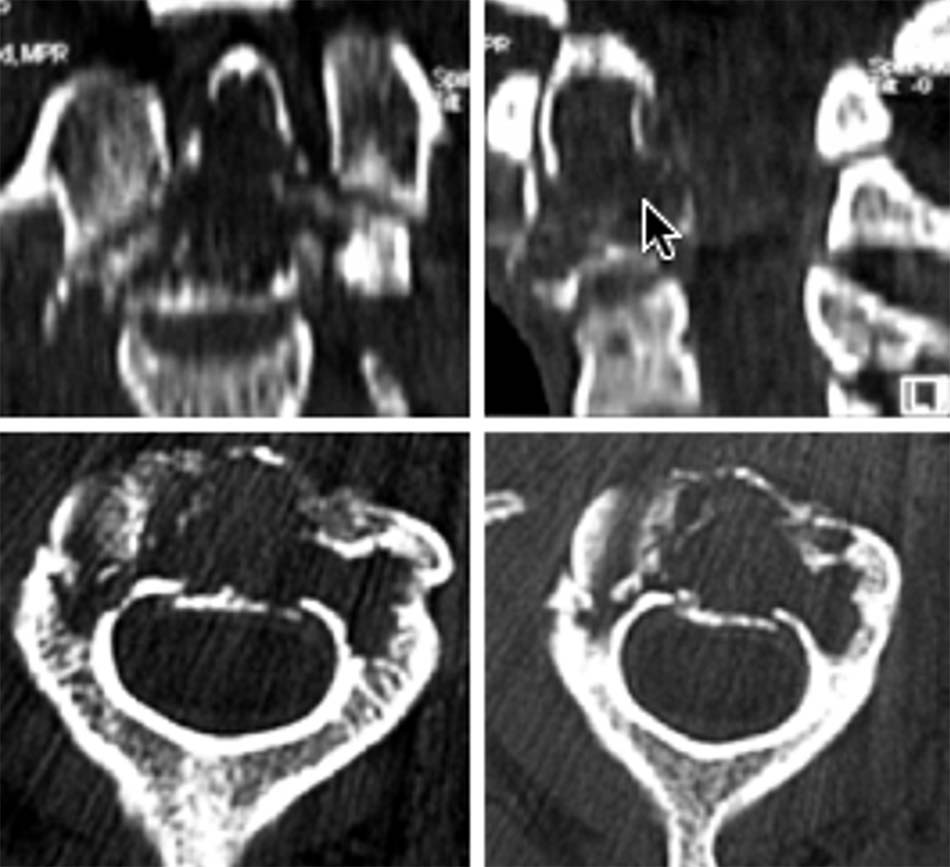
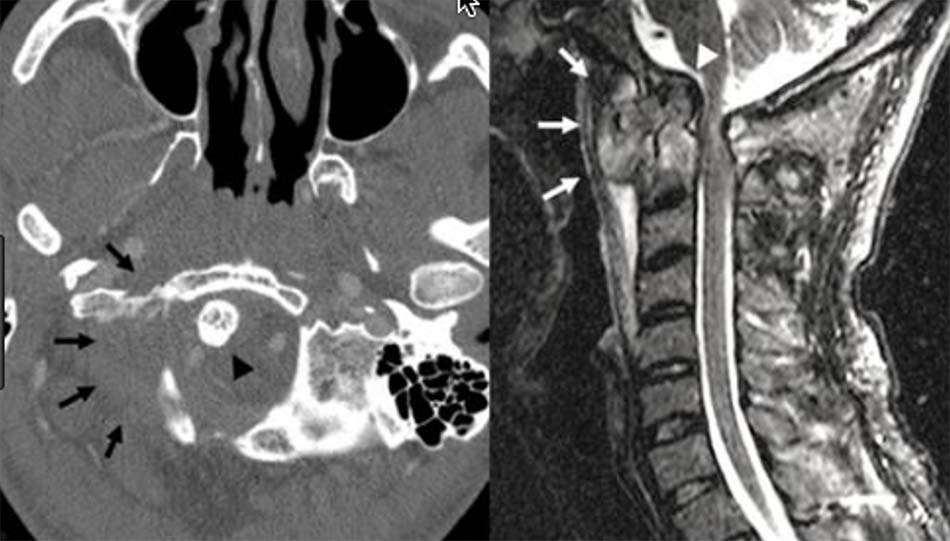
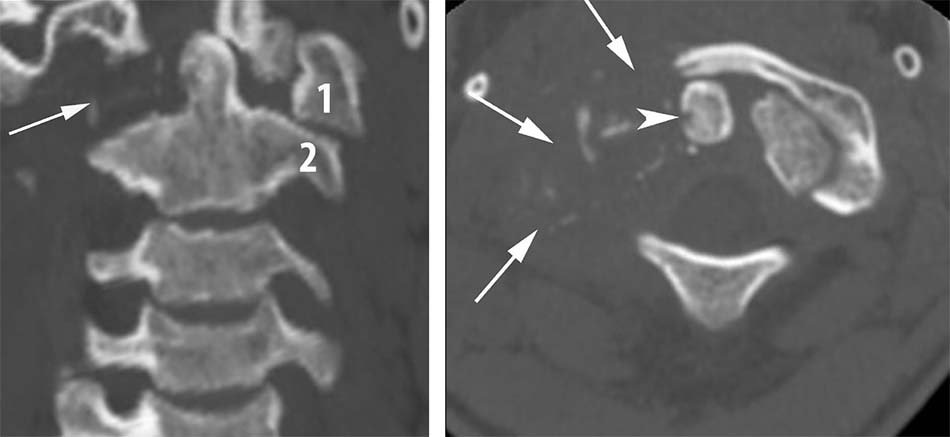
Bên cạnh các tổn thương phức hợp C1-C2 do chấn thương, bệnh lý, do khối u… chúng ta vẫn gặp các nguyên nhân khác như do viêm, lao hoặc nấm. Khi các tổn thương này lan tỏa gây phá hủy các cấu trúc giải phẫu làm mất vững cột sống cần phải chỉ định phẫu thuật. Tuy nhiên, việc lựa chọn đường mổ và phương pháp tái tạo đốt sống trong các tổn thương này cũng là một thách thức với các phẫu thuật viên cột sống. Bên cạnh lựa chọn phương pháp phẫu thuật thích hợp cho các tổn thương mất vững thì cần phải điều trị nguyên nhân gây nên các tổn thương này như viêm, lao hoặc nấm gây nên.
Tài liệu tham khảo
1. Canale S.Terry & James H.Beaty (2007), “BASILAR IMPRESSION”, Campbell’s Operative Orthopaedics.
2. Goel A. (2004), “Treatment of basilar invagination by atlantoaxial joint distraction and direct lateral mass fixation”, J Neurosurg Spine, 1(3): p. 281-6.
3. Goel A., Bhatjiwale M. & Desai K. (1998), “Basilar invagination: a study based on 190 surgically treated patients”, J Neurosurg, 88(6): p. 962-8.
4. Sawin P.D. & Menezes A.H. (1997), “Basilar invagination in osteogenesis imperfecta and related osteochondrodysplasias: medical and surgical management”, J Neurosurg, 86(6): p. 950-60.
5. Trịnh Văn Minh (1998), “Giải phẫu định khu Đầu Mặt Cổ, giải phẫu người”, Nhà xuất bản Y hoc tr 518-520.
6. Hà Kim Trung (2005), “Nghiên cứu chẩn đoán và điều trị phẫu thuật chấn thương cột sống cổ có thương tổn thần kinh tại bệnh viện Việt Đức”, Luận văn Tiến sĩ y học, Trường Đại học Y Hà Nội.
7. Alker G.J, Y. S. Oh & E. V. Leslie (1978), “High cervical spine and craniocervical junction injuries in fatal traffic accidents: a radiological study”, Orthop Clin North Am, 9(4): p. 1003-10.
8. Allen Ar (1991), “surgery of experimental lesion of the spinal cord equivalent to crush injury of fracture dislocation of the spine column”, JAMA, 57(878-880).
9. Howard S. An (2000), “Anatomy and Surgical Approaches to the spine”, Surgery of spine trauma, chapter 1: p. 10-11.
10. Montesano Px Anderson Pa ( 1988), “Morphology and treatment of occipital condyle fractures”, Spine . 13: p. 731.
11. Andrei F. Joaquim Md & Alpesh A. Patel Md (2010), “C1 and C2 Spine Trauma: Evaluation, Classification and Treatment”, Contemporary Spine Surgery, 11
12. Asheesh Bedi Md & Robert N. Hensingert Md (2006), “Congenital Anomalies of the Cervical Spine”, the Spine, fifth Edition(chapter 39): p. 630-671.
13. Babak Arvin Mbbs Phd, Marie-Pierre, Md Fournier-Gosselin & Md Michael G. Fehlings, Phd (2010), “Os Odontoideum: Etiology and Surgical Management”, Neurosurgery, 66: p. A22-A31.
14. Bahadur R., Goyal T., Dhatt S.S. & Tripathy S.K. (2010), “Transarticular screw fixation for atlantoaxial instability – modified Magerl’s technique in 38 patients”, J Orthop Surg Res, 5: p. 87.
15. H. Brattstrom (1986), “Cervical spine in polyarthritis. Radiology, indications for surgery and results”, Orthopade, 15(4): p. 291-6.
16. Christopher E. Wolfla Md (2006), “Anatomical, biomechanical, and practical considerations in posterior occipitocervical instrumentation”, The Spine Journal, 6: p. 225S-232S.
17. D. L. Daniels, A. L. Williams & V. M. Haughton (1983), “Computed tomography of the articulations and ligaments at the occipito-atlantoaxial region”, Radiology, 146(3): p. 709-16.
18. Hong Mx Dong Y, Jianyi L, Lin My (2003), “Quantitative anatomy of the lateral mass of the atlas”, Spine 2003;28:860-3.
19. Ebraheim N. A., Misson J. R., Xu R & Yeasting R. A. (2000), “The optimal transarticular C1 – C2 screw length and the location of the hypoglossal nerve”, Surg Neurol, 53(3): p. 208-10.
20. Levine Am Edward Cc (1991), “Fracture of the atlas”, J. Bone Joint Surgery, 73: p. 680-691.
21. Gokflin Sengul & Hakan Hadi Kadioglu (2006), “Morphometric Anatomy of the Atlas and Axis Vertebrae”, Turkish Neurosurgery 2006, Vol: 16, No: 2, 69-76.
22. Dickman Ca Hadley Mn, Browner Cm Et Al (1988), ” Acute traumatic atlas fractures: management and long term outcome”, Neurosurgery 23:31-5.
23. Julian A. Hanson, Anastasia V. Deliganis, Alexander B. Baxter, Wendy A. Cohen, Ken F. Linnau, Anthony J. Wilson & F. A. Mann (2002), “Radiologic and Clinical Spectrum of Occipital Condyle Fractures. Retrospective Review of 107 Consecutive Fractures in 95 Patients”, American Journal of Roentgenology, AJR ; 178:1261-1268.
24. Anders Holtz & Richard Levi (2010), Spinal cord injury, Oxford University Press,
25. Hong J. T., Lee S. W., Son B. C., Sung J. H., Kim I. S. & Park C. K. (2006), “Hypoglossal nerve palsy after posterior screw placement on the C1 lateral mass. Case report”, J Neurosurg Spine, 5(1): p. 83-5.
26. William C. Warner Jr (2007), “Anormalies of odontoid”, Campbell’s Operative Orthopaedics, 11th ed.
27. T. E. Keats, M. K. Dalinka, N. Alazraki, T. H. Berquist, R. H. Daffner, A. A. Desmet, G. Y. El-Khoury, T. G. Goergen, B. J. Manaster, A. Newberg, H. Pavlov, R. H. Haralson, 3rd, J. B. Mccabe & D. Sartoris (2000), “Cervical spine trauma. American College of Radiology. ACR Appropriateness Criteria”, Radiology, 215 Suppl: p. 243-6.
28. N. W. Kettner & G. M. Guebert (1991), “The radiology of cervical spine injury”, J Manipulative Physiol Ther, 14(9): p. 518-26.
29. Randall Loder T (2004), “Congenital Anomalies of the Cervical Spine “, Adult & Pediatric Spine, The 3rd Edition.
30. Spencer B. Gay Luke L. Yao Md, Md, Quan D. M. Vu Md, Mark W. Anderson, Md, Susan M. Powell, Md, Prakash N. Patel, Md (2000), “Imaging Evaluation of the Cervical Spine”, University of Virginia Health Sciences Center, Department of Radiology.
31. Kingsley R.Chin Md Sanfort E. Emery Md Mba (2006 ), “Surgical Managment of Rheumatoid Athritis”, the Spine, 1(chapter 43): p. 747-771.
32. Michele Calleja & Geoff Hide (2009), “Rheumatoid Arthritis, Spine”, Emedicine.
33. Ronald Moskovich (1997), “Cervical Instability( Rheumatoid, Dwarfism, Degenerative, Other )”, the Textbook of Spine Surgery, 1(56): p. 969-1009.
34. M. M. Panjabi, T. R. Oxland & E. H. Parks (1991), “Quantitative anatomy of cervical spine ligaments. Part I. Upper cervical spine”, J Spinal Disord, 4(3): p. 270-6.
35. Jr. Paul R. Meyer (1997), “Cervical Spine Fracture: Changing Management Concepts”, The Textbook of Spine Surgery volume 2(chapter 96): p. 1679-1741.
36. Randall T. Loder (2004), “Congenital Anomalies of the Cervical Spine “, Adult & Pediatric Spine, The 3rd Edition.
37. Effendi B Roy D, Cornish B, Dussault Rg, Laurin Ca (1981), “Fracture of the ring of the axis. A classification based on the analysis of 131 cases”, J. Bone Joint Surgery, 63: p. 319-327.
38. James H. Beaty S. Terry Canale, Cervical spinal injuries, in Campbell’s Operative Orthopaedics. 2007.
39. Paul E. Savas (2002), Biomechanics of the Injured Cervical Spine, in Fractures of cervical, thoracic and lumbar spine, Marcel Dekker, Inc,
40. Eric D. Schwartz & Adam E. Flanders (2007), “Spinal Trauma: Imaging, Diagnosis, and Management”, 1st Edition, Lippincott Williams & Wilkins.
41. Spence Kf. Decker S Sell Kw (1970), “Bursting atlantal fracture assosiated with rupture of the transverse ligament”, J. Bone Joint Surgery, 52: p. 543- 549.
42. Alexander R. Vaccaro (2002), Fractures of the cervical, thoracic and lumbar spine, Marcel Dekker, Inc,
43. Wesley W Parke Phd, Christopher M. Bono Md & Steven R. Gafin Md (2006), “Development of the Spine”, The Spine, Chapter 1: p. 3-15.
44. Christopher M. Bono Md Wesley W Parke Phd, Steven R. Gafin,Md (2006), “Applied Anatomy of the Spine”, the spine, 1(chapter 2): p. 16-54.
45. William F & Vincent Silvaggo (1997), “Surgery for Rheumatoid Arthritis of the Cervical Spine”, The Spinal Surgery, 82: p. 1439- 1455.
46. Frank H Netter.Md (1997), “Human Atlas ( Giải phẫu người )”, Nhà xuất bản Y hoc.
47. B. Althoff (1979), “Fracture of the odontoid process. An experimental and clinical study”, Acta Orthop Scand Suppl, 177: p. 1-95.
48. R. W. Bucholz & W. Z. Burkhead (1979), “The pathological anatomy of fatal atlanto-occipital dislocations”, J Bone Joint Surg Am, 61(2): p. 248-50.
49. B. J. Doherty & M. H. Heggeness (1994), “The quantitative anatomy of the atlas”, Spine (Phila Pa 1976), 19(22): p. 2497-500.
50. M. N. Hadley, C. Browner & V. K. Sonntag (1985), “Axis fractures: a comprehensive review of management and treatment in 107 cases”, Neurosurgery, 17(2): p. 281-90.
51. R. N. Hensinger, J. W. Fielding & R. J. Hawkins (1978), “Congenital anomalies of the odontoid process”, Orthop Clin North Am, 9(4): p. 901-12.
52. M. Watanabe, Y. Toyama & Y. Fujimura (1996), “Atlantoaxial instability in os odontoideum with myelopathy”, Spine (Phila Pa 1976), 21(12): p. 1435-9.
53. C. E. Heyde, U. Weber & R. Kayser (2006), “Instability of the upper cervical spine due to rheumatism”, Orthopade, 35(3): p. 270-87. 54.
54. Cacciola, F., U. Phalke, and A. Goel, Vertebral artery in relationship to C1-C2 vertebrae: an anatomical study. Neurology India, 2004. 52(2): p. 178.
55. Neo, M., et al., Vertebral artery injury during cervical spine surgery: a survey of more than 5600 operations. Spine, 2008. 33(7): p. 779-785.
56. Wang, J., et al., An anatomic consideration of C2 vertebrae artery groove variation for individual screw implantation in axis. European Spine Journal, 2013. 22(7): p. 1547-1552.
57. Yamazaki, M., et al., Anomalous vertebral arteries in the extra-and intraosseous regions of the craniovertebral junction visualized by 3-dimensional computed tomographic angiography: analysis of 100 consecutive surgical cases and review of the literature. Spine, 2012. 37(22): p. E1389-E1397.
58. Vaněk, P., et al., Vertebral artery and osseous anomalies characteristic at the craniocervical junction diagnosed by CT and 3D CT angiography in normal Czech population: analysis of 511 consecutive patients. Neurosurgical review, 2017. 40(3): p. 369-376.
59. Wakao, N., et al., Vertebral artery variations and osseous anomaly at the C1-2 level diagnosed by 3D CT angiography in normal subjects. Neuroradiology, 2014. 56(10): p. 843-849.
60. Tokuda, K., et al., Anomalous atlantoaxial portions of vertebral and posterior inferior cerebellar arteries. Neuroradiology, 1985. 27(5): p. 410-413.
61. Lovrencić-Huzjan, A., et al., Role of vertebral artery hypoplasia in migraine. Cephalalgia, 1998. 18(10): p. 684-686.
62. Lang, J., Wurzburg Skull Base and Related Structures. Atlas of Clinical Anatomy. J. Lang.− Stuttgart, 1995.
63. Yeom, J.S., et al., Undetected vertebral artery groove and foramen violations during C1 lateral mass and C2 pedicle screw placement. Spine, 2008. 33(25): p. E942-E949. 6
4. Wajanavisit, W., et al., Prevalence of high-riding vertebral artery and morphometry of C2 pedicles using a novel computed tomography reconstruction technique. Asian spine journal, 2016. 10(6): p. 1141-1148.
65. Shen, F.H., D. Samartzis, and R.G. Fessler, Textbook of the Cervical Spine E-Book. 2014: Elsevier Health Sciences.
66. Currier, B.L., et al., Anatomic relationship of the internal carotid artery to the C1 vertebra: a case report of cervical reconstruction for chordoma and pilot study to assess the risk of screw fixation of the atlas. Spine, 2003. 28(22): p. E461-E467.